解答题-原理综合题 较难0.4 引用1 组卷138
氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
 N2(g)+
N2(g)+ O2(g)
O2(g) NO(g)△H1=+90kJ/mol(常温下平衡常数为K1)
NO(g)△H1=+90kJ/mol(常温下平衡常数为K1)
N2(g)+2O2(g) 2NO2(g)△H2=+68kJ/mol(常温下平衡常数为K2)
2NO2(g)△H2=+68kJ/mol(常温下平衡常数为K2)
则2NO(g)+O2(g) 2NO2(g)△H=
2NO2(g)△H=__ kJ/mol;【常温下平衡常数K=___ (用K1、K2来表示)】
(2)对于反应2NO(g)+O2(g) 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
第一步:2NO(g) N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)→2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v正=k1正·c2(NO),v逆=k1逆·c(N2O2),其中k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是__ 。
A.整个反应的速率由第一步反应速率决定
B.同一温度下,平衡时第一步反应的 越大,反应正向程度越大
越大,反应正向程度越大
C.第二步反应速率慢,因而平衡转化率也低
D.第二步反应的活化能比第一步反应的活化能高
(3)在密闭容器中充入等物质的量的CO和NO气体,发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g)△H<0,如图为平衡时NO的体积分数与温度、压强的关系:
2CO2(g)+N2(g)△H<0,如图为平衡时NO的体积分数与温度、压强的关系:

①若在D点对反应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的__ 点(填字母)。
②E点的CO的转化率为__ 。
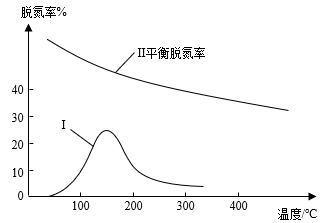
③某研究小组探究该反应中催化剂对脱氮率(即NO转化率)的影响。将相同量的NO和CO以一定的流速分别通过催化剂a和b,相同时间内测定尾气,a结果如图中曲线I所示。已知:催化效率b>a;b的活性温度约450℃。在图中画出b所对应的曲线((从300℃开始画)__ 。
(1)已知汽车气缸中氮及其化合物发生如下反应:
N2(g)+2O2(g)
则2NO(g)+O2(g)
(2)对于反应2NO(g)+O2(g)
第一步:2NO(g)
第二步:N2O2(g)+O2(g)→2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v正=k1正·c2(NO),v逆=k1逆·c(N2O2),其中k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是
A.整个反应的速率由第一步反应速率决定
B.同一温度下,平衡时第一步反应的
C.第二步反应速率慢,因而平衡转化率也低
D.第二步反应的活化能比第一步反应的活化能高
(3)在密闭容器中充入等物质的量的CO和NO气体,发生反应2CO(g)+2NO(g)

①若在D点对反应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的
②E点的CO的转化率为
③某研究小组探究该反应中催化剂对脱氮率(即NO转化率)的影响。将相同量的NO和CO以一定的流速分别通过催化剂a和b,相同时间内测定尾气,a结果如图中曲线I所示。已知:催化效率b>a;b的活性温度约450℃。在图中画出b所对应的曲线((从300℃开始画)

20-21高二上·宁夏银川·期末
类题推荐
氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
N2(g)+O2(g) 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) ΔH=+68 kJ·mol-1
2NO2(g) ΔH=+68 kJ·mol-1
则2NO(g)+O2(g) 2NO2(g) ΔH=
2NO2(g) ΔH=___________ kJ·mol-1
(2)对于反应2NO(g)+O2(g) 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
第一步:2NO(g) N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g) 2NO2(g)(慢反应)
2NO2(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v正=k1正·c2(NO),v逆=k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是___________(填标号)。
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)  4CO2(g)+N2(g) ΔH<0.某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
4CO2(g)+N2(g) ΔH<0.某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
在此温度下,反应的平衡常数Kp=___________ kPa-1(Kp为以分压表示的平衡常数);若降低温度,再次平衡后,与原平衡相比体系压强(P总)减小的原因是___________ 。
(4)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,尾气中反应物及生成物浓度随温度的变化关系如图。

330℃以下的低温区发生的主要反应的化学方程式是___________ 。
(1)已知汽车气缸中氮及其化合物发生如下反应:
N2(g)+O2(g)
N2(g)+2O2(g)
则2NO(g)+O2(g)
(2)对于反应2NO(g)+O2(g)
第一步:2NO(g)
第二步:N2O2(g)+O2(g)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v正=k1正·c2(NO),v逆=k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是___________(填标号)。
| A.整个反应的速率由第一步反应速率决定 |
| B.同一温度下,平衡时第一步反应的k1正/k1逆越大,反应正向程度越大 |
| C.第二步反应速率低,因而转化率也低 |
| D.第二步反应的活化能比第一步反应的活化能高 |
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp=
(4)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,尾气中反应物及生成物浓度随温度的变化关系如图。

330℃以下的低温区发生的主要反应的化学方程式是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网





