解答题-实验探究题 较易0.85 引用2 组卷80
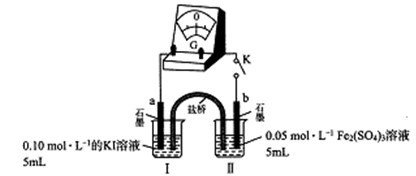
某兴趣小组用Fe3+与I-间的反应探究氧化还原反应规律与平衡移动原理的关系,回答下列问题:
(1)用Fe2(SO4)3晶体配制100 mL 0.05 mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓的硫酸中,再用水稀释,加入硫酸的目的是_____ (结合化学方程式回答)。
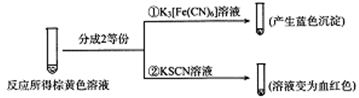
(2)甲组同学将0.10 mol/L的KI溶液和0.05 mol/L的Fe2(SO4)3溶液各5 mL混合充分反应后,溶液变为棕黄色,现进行如下实验①②。
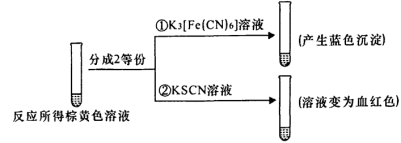
实验①中产生蓝色沉淀的离子方程式为_______ ,根据以上反应现象写出甲组同学实验中的离子方程式:_______ ,在甲组同学的反应中,I2和Fe3+的氧化性强弱顺序为_______ 。
(1)用Fe2(SO4)3晶体配制100 mL 0.05 mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓的硫酸中,再用水稀释,加入硫酸的目的是
(2)甲组同学将0.10 mol/L的KI溶液和0.05 mol/L的Fe2(SO4)3溶液各5 mL混合充分反应后,溶液变为棕黄色,现进行如下实验①②。

实验①中产生蓝色沉淀的离子方程式为
20-21高二上·陕西汉中·阶段练习
类题推荐
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是___________ 。
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___________ 。
(3)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:
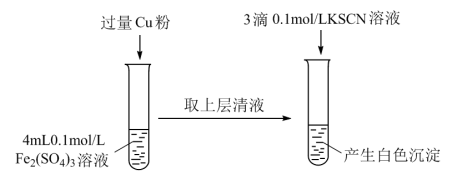
①Fe3+与Cu反应的离子方程式为___________ 。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN一的化学性质与I一相似;
iii.2Cu2++4I—=2CuI↓十I2。
填写实验方案:
Cu2+与SCN一反应的离子方程式为___________ 。
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为
(3)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN一的化学性质与I一相似;
iii.2Cu2++4I—=2CuI↓十I2。
填写实验方案:
| 实验方案 | 现象 |
| 步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1moL/L的KSCN溶液 | 无明显现象 |
| 步骤2:取4mL | 产生白色沉淀 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网