解答题-原理综合题 适中0.65 引用1 组卷45
氮氧化物是形成酸雨的成因之一,与其他污染物在一定条件下能产生光化学烟雾,加大对含氮化合物的处理是环境治理的重要方面。
(1)NH3催化还原NOx是目前应用最广泛的烟气氮氧化物脱除技术。已知
①4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H1
2N2(g)+6H2O(g) △H1
②N2(g)+O2(g) 2NO(g) △H2
2NO(g) △H2
③H2O(g)=H2O(l) △H3
则反应4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H=
5N2(g)+6H2O(l) △H=_______ (用△H1、△H2、△H3表示)。
(2)科学家用活性炭还原法可以消除NO的污染,发生的反应为C(s)+2NO(g) N2(g)+CO2(g)。1 mol NO和足量的活性炭在T℃、1 L恒容密闭容器中反应,10 min后达到平衡,测得NO的物质的量为0.5 mol。
N2(g)+CO2(g)。1 mol NO和足量的活性炭在T℃、1 L恒容密闭容器中反应,10 min后达到平衡,测得NO的物质的量为0.5 mol。
①10 min内,v(N2)=_____ mol·L-1·min-1,在T℃时,该反应的平衡常数K=____ 。
②在恒容绝热条件下,下列能判断该反应一定达到化学平衡状态的是_____ (填字母)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)已知:25℃时,HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.8×10-5 mol·L-1.实验室可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。
①已知溶液甲为0.1 mol·L-1 NaNO3和0.1 mol·L-1 NaNO2的混合溶液,溶液乙为0.1 mol·L-1的CH3COONa溶液,则两溶液中c( )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为_______ ,使溶液甲和溶液乙的pH相等的方法是______ (填字母)。
a.向溶液甲中加适量NaOH b.向溶液甲中加适量水
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
②一定温度下,等体积、等物质的量浓度CH3COONa和NaNO2两溶液中阴离子的总物质的量分别为n1、n2,则n1_______ (填“>”“<”或“=”)n2。
(1)NH3催化还原NOx是目前应用最广泛的烟气氮氧化物脱除技术。已知
①4NH3(g)+3O2(g)
②N2(g)+O2(g)
③H2O(g)=H2O(l) △H3
则反应4NH3(g)+6NO(g)
(2)科学家用活性炭还原法可以消除NO的污染,发生的反应为C(s)+2NO(g)
①10 min内,v(N2)=
②在恒容绝热条件下,下列能判断该反应一定达到化学平衡状态的是
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)已知:25℃时,HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.8×10-5 mol·L-1.实验室可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。
①已知溶液甲为0.1 mol·L-1 NaNO3和0.1 mol·L-1 NaNO2的混合溶液,溶液乙为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(
a.向溶液甲中加适量NaOH b.向溶液甲中加适量水
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
②一定温度下,等体积、等物质的量浓度CH3COONa和NaNO2两溶液中阴离子的总物质的量分别为n1、n2,则n1
20-21高二上·河南·阶段练习
类题推荐
雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法
(1)用活性炭还原法可以处理氨氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ· mol-1。
N2(g)+CO2(g) △H=Q kJ· mol-1。
在T℃时,反应进行到不同时间测得各物质的浓度如下表。
①0~10min 内,NO 的平均反应速率v(NO)=___________ 。
T1 ℃时,该反应的平衡常数K=___________ 。
②30min 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母)。___________ 。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min 后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3 ∶3,则Q________ 0(填“>”、“=”或“<”)。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。
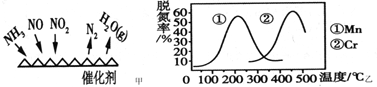
①由图甲可知,SCR技术中的氧化剂为___________ 。已知c(NO2)∶c(NO)=1∶1时脱氮效果最佳,若生成1mol N2时反应放出的热量为QkJ。此时对应的脱氮反应的热化学方程式为___________ 。
②图乙是不同催化剂Mn 和Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应的温度分别为________________ 。
(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.70mol·L-1,已知Ksp(CaSO3)=1.4×10-7,求吸收后溶液中SO32- 的浓度_____________________________________ 。
(1)用活性炭还原法可以处理氨氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)
 N2(g)+CO2(g) △H=Q kJ· mol-1。
N2(g)+CO2(g) △H=Q kJ· mol-1。在T℃时,反应进行到不同时间测得各物质的浓度如下表。
| 时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min 内,NO 的平均反应速率v(NO)=
T1 ℃时,该反应的平衡常数K=
②30min 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min 后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3 ∶3,则Q
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。

①由图甲可知,SCR技术中的氧化剂为
②图乙是不同催化剂Mn 和Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应的温度分别为
(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.70mol·L-1,已知Ksp(CaSO3)=1.4×10-7,求吸收后溶液中SO32- 的浓度
霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①0~10 min内,NO的平均反应速率v(NO)=_______________________ ,T1℃时,该反应的平衡常数K=____________ 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______ (填字母)。
a.升高温度 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q__________ (填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
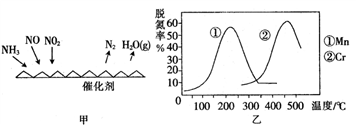
①由图甲可知,SCR技术中的氧化剂为_______________ 。已知c(NO2):c(NO)=1:1时脱氮效果最佳, 若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为___________________________ 。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。已知常温下Ka1(H2SO3)=1.8×10-2 , Ka2(H2SO3)=6.0×10-9。常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=____________ 。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)
 N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
a.升高温度 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:

①由图甲可知,SCR技术中的氧化剂为
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。已知常温下Ka1(H2SO3)=1.8×10-2 , Ka2(H2SO3)=6.0×10-9。常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=
碳和氮、硫是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,SO2会形成酸雨,目前,这些有毒有害气体的处理成为科学研究的重要内容。
(1)已知热化学方程式:
①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H1
②C(s)+ O2(g)=CO2(g) △H2
③H2(g)+ O2(g)=H2O(l) △H3
O2(g)=H2O(l) △H3
则反应④2C(s)+H2(g)=C2H2(g)的△H 为_________________________ 。(用含△H1、△H2、△H3关系式表示)
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2+CO2(g) △H<0。在Tl℃时,反应进行到不同时间测得各物质的浓度(单位:mol/L)如下:
N2+CO2(g) △H<0。在Tl℃时,反应进行到不同时间测得各物质的浓度(单位:mol/L)如下:
①10〜20min内,NO的平均反应速率v(NO)=___________ ,
②30min后,只改变某-条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________ (填字母编号)。
a.通入一定量的NO b.加入一定量的c
c.适当升高反应体系的温度 d.加入合适的催化剂
e.适当缩小容器的体积
③若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)
=_________ mol/L。NO的转化率______ (填“增大”“减小”或“不变”)。
④下列说法中可以说明该反应已达到平衡状态的是_________ 。
a.体系内混合气体的密度保持不变 b.NO、N2、CO2、的物质的量之比为2∶1∶1
c.容器内气体的总压强保持不变 d. NO体积分数不再改变
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:____________________ ;
②当甲中消耗2.24LO2(标准状况)时,乙中________ (填“a”或“b”)增重________ g。
(1)已知热化学方程式:
①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H1
②C(s)+ O2(g)=CO2(g) △H2
③H2(g)+
则反应④2C(s)+H2(g)=C2H2(g)的△H 为
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)
 N2+CO2(g) △H<0。在Tl℃时,反应进行到不同时间测得各物质的浓度(单位:mol/L)如下:
N2+CO2(g) △H<0。在Tl℃时,反应进行到不同时间测得各物质的浓度(单位:mol/L)如下:0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10〜20min内,NO的平均反应速率v(NO)=
②30min后,只改变某-条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
a.通入一定量的NO b.加入一定量的c
c.适当升高反应体系的温度 d.加入合适的催化剂
e.适当缩小容器的体积
③若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)
=
④下列说法中可以说明该反应已达到平衡状态的是
a.体系内混合气体的密度保持不变 b.NO、N2、CO2、的物质的量之比为2∶1∶1
c.容器内气体的总压强保持不变 d. NO体积分数不再改变
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:
②当甲中消耗2.24LO2(标准状况)时,乙中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


