解答题-原理综合题 适中0.65 引用1 组卷258
乙酸、碳酸、次氯酸、草酸在生产、生活及医药方面有广泛用途。回答下列问题:
I.已知25℃时,部分物质的电离常数如表所示:
(1)a.CH3COOH、b.H2CO3、c.HClO的酸性由强到弱的顺序为_______ (填编号)。
(2)水存在如下平衡:H2O+H2O⇌H3O++OH-ΔH>0,现欲使平衡向右移动,结果使溶液显碱性,应选择方法_______ 。
A.向水中加入NaHSO4固体 B.向水中加入NaOH固体 C.加热至100℃ D.向水中加入Na
(3)NaClO溶液显碱性的原因(用化学用语表示)_______ 。
(4)向NaClO溶液中通入少量的CO2,反应的离子方程式为_______ 。
(5)pH相同等体积的下列三种物质的溶液:a.HCl,b.H2SO4,c.CH3COOH滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体积分别为V1、V2、V3则三者的大小关系_______ 。
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
(6)25℃时,有两种溶液:①0.10mol·L-1CH3COOH溶液,②Na2CO3溶液,下列说法正确的是_______ (填字母)。
A.CH3COOH和Na2CO3都属于强电解质
B.①中:c(CH3COOH)+c(CH3COO-) = 0.10mol·L-1
C.②中:c(Na+)>c(OH-)>c(CO ) > c(HCO
) > c(HCO )>c(H+)
)>c(H+)
II.乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1)室温下,测得0.1 mol·L-1 H2C2O4溶液的pH =1.3,写出草酸的电离方程式_______ 。
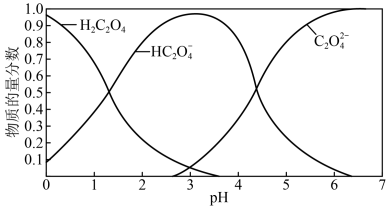
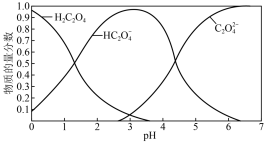
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
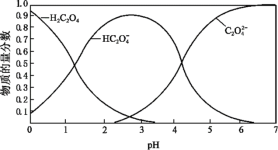
①向草酸溶液中滴加KOH溶液至pH=2.5时发生的主要反应的离子方程式是_______ 。
②0.1 mol·L-1 KHC2O4溶液中,下列粒子浓度关系正确的是_______ (填序号)。
a.c(K+)+c(H+)=c(HC2O )+c(C2O
)+c(C2O )+c(OH-)
)+c(OH-)
b.c(K+)>c(HC2O ) > c(C2O
) > c(C2O ) > c(H2C2O4)
) > c(H2C2O4)
c.c(K+)=c(HC2O ) + c(C2O
) + c(C2O )+c(H2C2O4)
)+c(H2C2O4)
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2++H2C2O4+xH2O FeC2O4·xH2O↓+2H+
FeC2O4·xH2O↓+2H+
①制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:_______ 。
②测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+,则FeC2O4·xH2O中x=_______ (FeC2O4的摩尔质量是144 g·mol-1)。
I.已知25℃时,部分物质的电离常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(2)水存在如下平衡:H2O+H2O⇌H3O++OH-ΔH>0,现欲使平衡向右移动,结果使溶液显碱性,应选择方法
A.向水中加入NaHSO4固体 B.向水中加入NaOH固体 C.加热至100℃ D.向水中加入Na
(3)NaClO溶液显碱性的原因(用化学用语表示)
(4)向NaClO溶液中通入少量的CO2,反应的离子方程式为
(5)pH相同等体积的下列三种物质的溶液:a.HCl,b.H2SO4,c.CH3COOH滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体积分别为V1、V2、V3则三者的大小关系
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
(6)25℃时,有两种溶液:①0.10mol·L-1CH3COOH溶液,②Na2CO3溶液,下列说法正确的是
A.CH3COOH和Na2CO3都属于强电解质
B.①中:c(CH3COOH)+c(CH3COO-) = 0.10mol·L-1
C.②中:c(Na+)>c(OH-)>c(CO
II.乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1)室温下,测得0.1 mol·L-1 H2C2O4溶液的pH =1.3,写出草酸的电离方程式
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:

①向草酸溶液中滴加KOH溶液至pH=2.5时发生的主要反应的离子方程式是
②0.1 mol·L-1 KHC2O4溶液中,下列粒子浓度关系正确的是
a.c(K+)+c(H+)=c(HC2O
b.c(K+)>c(HC2O
c.c(K+)=c(HC2O
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2++H2C2O4+xH2O
①制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:
②测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+,则FeC2O4·xH2O中x=
20-21高二上·北京海淀·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网