解答题-工业流程题 适中0.65 引用1 组卷77
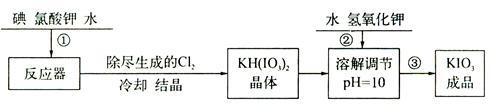
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)已知步骤①反应器中发生反应的化学方程式为
 。
。
参照碘酸钾的溶解度:
操作③得到碘酸钾晶体,方法是____________________________ 、_________________________________ 。
(2)已知: ;
; 。
。
检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有_________________________________ 。
(3)检验加碘食盐中碘的含量学生乙设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
③以淀粉为指示剂,逐滴加入 的
的 溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是
溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是___________ mg/kg(以含w的代数式表示)。

(1)已知步骤①反应器中发生反应的化学方程式为
参照碘酸钾的溶解度:
温度/℃ | 20 | 40 | 60 | 80 |
| 8.08 | 12.6 | 18.3 | 24.8 |
(2)已知:
检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有
(3)检验加碘食盐中碘的含量学生乙设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
③以淀粉为指示剂,逐滴加入
20-21高一·全国·课时练习
类题推荐
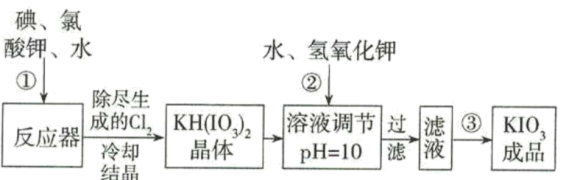
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:

(1)已知步骤①反应器发生的反应为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,该反应的还原产物为___ ;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是___ 。
(3)①已知:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32-=2I-+S4O62-,
测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是___ mol·kg-1(以含w的代数式表示)。
②学生乙又进行了下列实验:
请推测实验中产生蓝色现象的可能原因,用离子方程式表示___ 。
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:___ 。
(4)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①根据上述实验现象,加碘盐中可能含有的物质中不能确定的是___ 。
②第二份试液中加入足量KI固体后,反应的离子方程式为___ 。

(1)已知步骤①反应器发生的反应为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,该反应的还原产物为
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
(3)①已知:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32-=2I-+S4O62-,
测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是
②学生乙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配制溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol·L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1滴1mol·L-1的H2SO4,从发振荡 | 溶液变蓝色 |
请推测实验中产生蓝色现象的可能原因,用离子方程式表示
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:
(4)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①根据上述实验现象,加碘盐中可能含有的物质中不能确定的是
②第二份试液中加入足量KI固体后,反应的离子方程式为
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至 开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下硝酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下硝酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
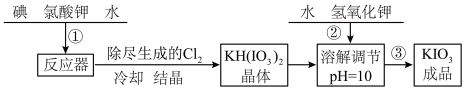
(1)步骤②中氢氧化钾的主要作用是_______
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过_______ 、过滤、洗涤、干燥等步骤
(3)已知: ;
;
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取 食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量
食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量 溶液,使
溶液,使 与
与 反应完全;最后加入指示剂,以物质的量浓度为
反应完全;最后加入指示剂,以物质的量浓度为 的
的 溶液滴定,消耗
溶液滴定,消耗 时恰好反应完全。
时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为_______ 、_______
②该实验可以用_______ 作指示剂,滴定终点的现象是_______
③下列有关该滴定实验的说法不正确的是_______
A.滴定管在使用前必须检查是否漏水并润洗
B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁
D.终点读数时俯视会导致碘的含量偏低

(1)步骤②中氢氧化钾的主要作用是
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过
| 温度 | 20 | 40 | 60 | 80 |
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取
①在滴定过程中,所用的玻璃仪器为
②该实验可以用
③下列有关该滴定实验的说法不正确的是
A.滴定管在使用前必须检查是否漏水并润洗
B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁
D.终点读数时俯视会导致碘的含量偏低
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网