解答题-实验探究题 适中0.65 引用4 组卷368
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应: ,且生成的I2立即与试剂X反应而被消耗。由于溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应
,且生成的I2立即与试剂X反应而被消耗。由于溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应 的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对 反应速率的影响。实验2中m=
反应速率的影响。实验2中m=_______ ,n=_______ 。
(2)一定温度下, 反应速率可以表示为
反应速率可以表示为 (k为常数),则:
(k为常数),则:
①根据上表数据关系可知,a、b的值依次为_______ 和_______ 。
②t=_______ 。
(3)实验5表明:
①硫酸铁能_______ 该反应速率。
②试用离子方程式表示 对
对 催化的过程为2Fe3++2I-=2Fe2++I2、
催化的过程为2Fe3++2I-=2Fe2++I2、_______ 。
(4)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致H2O2大量分解(已知温度为60℃时H2O2会分解50%以上),应该采取的加热方式是_______ 。
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| H2O | |||||||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对
(2)一定温度下,
①根据上表数据关系可知,a、b的值依次为
②t=
(3)实验5表明:
①硫酸铁能
②试用离子方程式表示
(4)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致H2O2大量分解(已知温度为60℃时H2O2会分解50%以上),应该采取的加热方式是
18-19高一下·福建莆田·期中
类题推荐
已知:将 KI、盐酸、试剂 X 和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应H2O2+2H++2I-=2H2O+I2,且生成的 I2 立即与试剂 X反应而被消耗。一段时间后,试剂 X被生成的I2完全消耗。由于溶液中I-继续被 H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂 X 的量、滴入双氧水至溶液变蓝所需时间,即可推算反应H2O2+2H++2I-=2H2O+I2的反应速率。某同学依据上述原理设计实验,实验记录如下表所示:
回答下列问题:
(1)实验1和2的目的是探究 H2O2浓度对反应速率的影响,则V=___________ ;实验3和4的目的是探究 KI浓度对反应速率的影响,则T=___________ 。
(2)探究温度对反应速率的影响的实验组合为实验___________ 和___________ 。由题中数据可知,温度由20℃升高到 30℃,反应速率增大为原来的___________ 倍。
(3)若一定温度下,反应H2O2+2H++2I-=2H2O+I2的速率方程可以表示为 v=k·ca(H2O2)·cb(I-)·c(H+)(k为反应速率常数),化学反应的速率方程中各物质浓度的指数称为各物质的分级数,所有指数的总和称为反应总级数。请根据上表数据计算,a=___________ ,b=___________ ,反应总级数为___________ 。
| 编号 | 往烧杯中加入的试剂及其用量/mL | 温度/℃ | 溶液变蓝所需时间/s | ||||
| 0.1mol/LKI溶液 | H2O | 0.01 mol/LX溶液 | 0.1mol·L-1双氧水 | 0.1mol/L稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 20 | 120 |
| 2 | 20.0 | 20.0 | 10.0 | V | 20.0 | 20 | 240 |
| 3 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 30 | 40 |
| 4 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | T | 80 |
(1)实验1和2的目的是探究 H2O2浓度对反应速率的影响,则V=
(2)探究温度对反应速率的影响的实验组合为实验
(3)若一定温度下,反应H2O2+2H++2I-=2H2O+I2的速率方程可以表示为 v=k·ca(H2O2)·cb(I-)·c(H+)(k为反应速率常数),化学反应的速率方程中各物质浓度的指数称为各物质的分级数,所有指数的总和称为反应总级数。请根据上表数据计算,a=
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率。
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m=___ ,n=___ 。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>___ ,才确保看到蓝色。
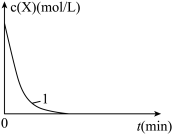
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注)。____
(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂___ (填“提高”或“降低”)了反应活化能。
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1mol·Lˉ1KI溶液 | H2O | 0.01mol·Lˉ1X溶液 | 0.1mol·Lˉ1双氧水 | 1mol·Lˉ1稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m=
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注)。

(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂
某实验小组为探究酸性的碘化钾与过氧化氢反应的速率,进行了相关的实验探究:
(1)实验1:向用硫酸酸化的碘化钾溶液里加入过氧化氢溶液,不久就有无色小气泡从溶液中逸出,向溶液里滴入淀粉溶液显蓝色,写出此过程对应的离子方程式:________ 。
(2)实验中发现,由于淀粉溶液很快显蓝色,所以无法测定酸性的碘化钾与过氧化氢完全反应时的速率。经查阅资料,碘和Na2S2O3可以发生如下反应:I2+2S2O = 2I-+S4O
= 2I-+S4O ,且反应速率非常快。据此,同学们设计了实验2:
,且反应速率非常快。据此,同学们设计了实验2:
将KI、盐酸、试剂Na2S2O3和淀粉四种溶液混合,无反应发生。向混合液中加入过氧化氢溶液后,I-被过氧化氢氧化,生成的I2立即与试剂Na2S2O3反应而被消耗。一段时间后,当混合液中Na2S2O3被反应生成的I2完全消耗后,由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂Na2S2O3的量、滴入双氧水至溶液变蓝所需的时间,即可推算酸性的碘化钾与过氧化氢反应的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
回答下列问题:
①已知:实验2-1、2-2的目的是探究H2O2浓度对酸性的碘化钾与过氧化氢的反应速率的影响。实验2-2中m=____________ ,n=_________ 。
②实验2-3从开始至反应进行到5.6 min时,此段时间内酸性的碘化钾与过氧化氢的反应速率v(I-)=____ 。
③一定温度下,酸性的碘化钾与过氧化氢的反应速率可以表示为v=k·c a(H2O2)·c b(I-)·c(H+)(k为常数),则:
a.实验2-4时,烧杯中溶液开始变蓝的时间t=___________ 。
b.根据上表数据可知,a、b的值依次为_____ 和_______ 。
(3)实验过程中,有同学猜想:KI对于H2O2的分解具有催化作用。为验证这一猜想,同学们需要设计出探究KI的浓度对H2O2分解反应速率的影响的实验。
实验装置如下:
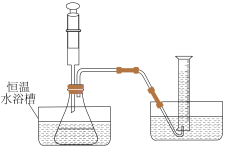
限选试剂:30% H2O2、0.1mol∙L-1KI溶液、蒸馏水、秒表。
参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。________

如气体体积数据都已转化为标准状况下,用表格中字母表示出实验1以H2O2表示的反应速率_________ .
(1)实验1:向用硫酸酸化的碘化钾溶液里加入过氧化氢溶液,不久就有无色小气泡从溶液中逸出,向溶液里滴入淀粉溶液显蓝色,写出此过程对应的离子方程式:
(2)实验中发现,由于淀粉溶液很快显蓝色,所以无法测定酸性的碘化钾与过氧化氢完全反应时的速率。经查阅资料,碘和Na2S2O3可以发生如下反应:I2+2S2O
将KI、盐酸、试剂Na2S2O3和淀粉四种溶液混合,无反应发生。向混合液中加入过氧化氢溶液后,I-被过氧化氢氧化,生成的I2立即与试剂Na2S2O3反应而被消耗。一段时间后,当混合液中Na2S2O3被反应生成的I2完全消耗后,由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂Na2S2O3的量、滴入双氧水至溶液变蓝所需的时间,即可推算酸性的碘化钾与过氧化氢反应的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 0.1mol·L-1 KI溶液/mL | H2O/mL | 0.01mol·L-1 Na2S2O3溶液/mL | 0.1mol·L-1 双氧水/mL | 1mol·L-1 稀盐酸/mL | 催化剂 | 溶液开始变蓝时间(min) |
| 2-1 | 40.0 | 20.0 | 20.0 | 40.0 | 40.0 | 无 | 2.8 |
| 2-2 | 40.0 | m | 20.0 | 20.0 | n | 无 | 5.6 |
| 2-3 | 20.0 | 40.0 | 20.0 | 40.0 | 40.0 | 无 | 5.6 |
| 2-4 | 40.0 | 0 | 20.0 | 20.0 | 80.0 | 无 | t |
| 2-5 | 40.0 | 20.0 | 20.0 | 40.0 | 40.0 | 5滴Fe2(SO4)3 | 1.2 |
回答下列问题:
①已知:实验2-1、2-2的目的是探究H2O2浓度对酸性的碘化钾与过氧化氢的反应速率的影响。实验2-2中m=
②实验2-3从开始至反应进行到5.6 min时,此段时间内酸性的碘化钾与过氧化氢的反应速率v(I-)=
③一定温度下,酸性的碘化钾与过氧化氢的反应速率可以表示为v=k·c a(H2O2)·c b(I-)·c(H+)(k为常数),则:
a.实验2-4时,烧杯中溶液开始变蓝的时间t=
b.根据上表数据可知,a、b的值依次为
(3)实验过程中,有同学猜想:KI对于H2O2的分解具有催化作用。为验证这一猜想,同学们需要设计出探究KI的浓度对H2O2分解反应速率的影响的实验。
实验装置如下:

限选试剂:30% H2O2、0.1mol∙L-1KI溶液、蒸馏水、秒表。
参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。

如气体体积数据都已转化为标准状况下,用表格中字母表示出实验1以H2O2表示的反应速率
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


