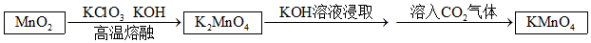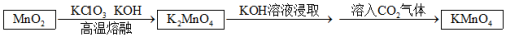解答题-实验探究题 适中0.65 引用1 组卷89
高锰酸钾是一种重要的氧化剂,某化学实验小组制备高锰酸钾并测其纯度的实验方案如下。请回答下列问题:
I.高锰酸钾的制备
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3过滤,最后从滤液中分离得到高锰酸钾晶体。
(1)将二氧化锰、氯酸钾和氢氧化钾固体放入______ ( 填字母)中熔融制K2MnO4。
A.烧杯 B.瓷坩埚 C.蒸发皿 D.铁坩埚
(2)制K2MnO4反应的化学方程式为______
(3)能否用浓盐酸代替步骤二中的CO2,请简要分析原因______
(4)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的滤液中分离得到高锰酸钾晶体的方法是______ 、过滤、洗涤、烘干。为进一步提纯所得到的产品,常采用的实验方法是______ ;
一些化合物的溶解度S/g(100gH2O)-1
II.高锰酸钾纯度的测定
(5)称取mgKMnO4粗品,加入煮沸并冷却后的稀硫酸配成V0mL溶液。量取V1mLc1 mol/L的草酸( H2C2O2)溶液于锥形瓶中,用所配KMnO4溶液进行滴定。重复滴定两次,平均消耗KMnO4溶液的体积为V2 mL。
①滴定开始时,溶液颜色褪去较慢,随后明显加快,原因是______ 。(反应热效应不明显,可忽略不计)
②滴定终点的标志是______
③KMnO4纯度(质量分数)的计算式为______ 。
I.高锰酸钾的制备
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3过滤,最后从滤液中分离得到高锰酸钾晶体。
(1)将二氧化锰、氯酸钾和氢氧化钾固体放入
A.烧杯 B.瓷坩埚 C.蒸发皿 D.铁坩埚
(2)制K2MnO4反应的化学方程式为
(3)能否用浓盐酸代替步骤二中的CO2,请简要分析原因
(4)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的滤液中分离得到高锰酸钾晶体的方法是
一些化合物的溶解度S/g(100gH2O)-1
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
| K2CO3 | 51.3 | 52 | 52.5 | 53.2 | 53.9 | 54.8 |
| KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
(5)称取mgKMnO4粗品,加入煮沸并冷却后的稀硫酸配成V0mL溶液。量取V1mLc1 mol/L的草酸( H2C2O2)溶液于锥形瓶中,用所配KMnO4溶液进行滴定。重复滴定两次,平均消耗KMnO4溶液的体积为V2 mL。
①滴定开始时,溶液颜色褪去较慢,随后明显加快,原因是
②滴定终点的标志是
③KMnO4纯度(质量分数)的计算式为
21-22高三上·山西运城·期末
类题推荐
某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式____________________________ ,此反应不能用瓷坩埚,原因是(用化学方程式表示)_________________________________ ;
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因__________________________ ;
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、_____________ ,过滤、洗涤、烘干。为进一步增加得到的产品(高锰酸钾晶体)的纯度,常采用的实验方法是____________ ;
一些化合物的溶解度S/g(100g H2O)-1
(4)按以上方法制备高锰酸钾,每3 mol K2MnO4彻底反应理论上生成_________ mol KMnO4;为增大锰酸钾的原子利用率,更好的制备方法是电解法。以K2MnO4溶液为电解液,采用惰性电极电解,当阴极在标准状况下产生5.6 L H2时,产生KMnO4的物质的量是________ mol。
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、
一些化合物的溶解度S/g(100g H2O)-1
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网