解答题-原理综合题 较难0.4 引用1 组卷320
氧族元素及其化合物在生产、生活中发挥着重要的作用。回答下列问题:
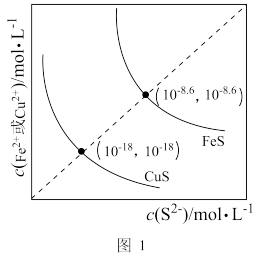
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下 饱和溶液中,
饱和溶液中, 和
和 关系如图所示,
关系如图所示,
___________ ;图中a、b、c三点对应的溶液中,一定存在 沉淀的是
沉淀的是___________ (填序号)。
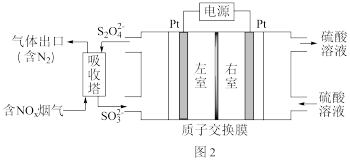
(2)工业上常用连二亚硫酸钠 消除烟气中的
消除烟气中的 ,通过电解可使
,通过电解可使 再生,装置如图所示。吸收塔内发生的离子反应方程式为
再生,装置如图所示。吸收塔内发生的离子反应方程式为___________ 。吸收塔内每吸收 的
的 ,理论上
,理论上 电极上会放出
电极上会放出___________  气体(气体体积均为标准状况)。
气体(气体体积均为标准状况)。
(3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸( )和硒酸(
)和硒酸( ),进而制备单质硒。亚硒酸(
),进而制备单质硒。亚硒酸( )在溶液中存在多种微粒形态,25℃时各微粒的分布系数
)在溶液中存在多种微粒形态,25℃时各微粒的分布系数 与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
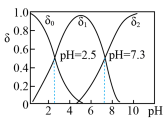
①将 滴入
滴入 溶液中,当pH达到2.0时,发生反应的离子方程式是
溶液中,当pH达到2.0时,发生反应的离子方程式是___________ 。
②25℃时, 溶液的pH<7,通过计算和必要的文字加以解释:
溶液的pH<7,通过计算和必要的文字加以解释:___________ 。
③已知硒酸的电离方程式为: ,
, 。25℃时,下列关于
。25℃时,下列关于
 溶液的说法错误的是
溶液的说法错误的是___________ 。
A.
B.
C.
D.
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下

(2)工业上常用连二亚硫酸钠

(3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸(

①将
②25℃时,
③已知硒酸的电离方程式为:
A.
B.
C.
D.
20-21高二上·山东威海·期末
类题推荐
元素及其化合物在生活及生产中有很多重要用途,请回答下列问题:
(1)常温下29.4%的硫酸的密度为 ,取5.0mL该溶液稀释到360mL,稀释后溶液的pH=
,取5.0mL该溶液稀释到360mL,稀释后溶液的pH=_______ 。
(2)常温下,将 的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。①浓度为
的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。①浓度为 的氨水bL;②
的氨水bL;② 的氨水cL;③
的氨水cL;③ 的氢氧化钡溶液dL。则a、b、c、d之间由大到小的关系是
的氢氧化钡溶液dL。则a、b、c、d之间由大到小的关系是_______ 。
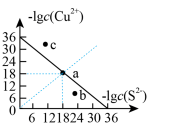
(3)通过控制溶液的pH对工业废水中的金属离子进行分离,下图是某些金属氢氧化物在不同浓度和pH时的沉淀—溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。

① 、
、 、
、 三种物质的溶度积常数最大的是
三种物质的溶度积常数最大的是_______ 。图中A、B、C三点中表示 的沉淀速率大于溶解速率的是
的沉淀速率大于溶解速率的是_______ 。
②由图可知 的溶度积的值为
的溶度积的值为_______ 。
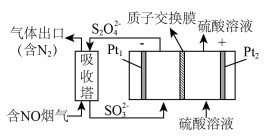
(4)工业上常用连二亚硫酸钠( )消除烟气中的NO,通过电解可使
)消除烟气中的NO,通过电解可使 再生,装置如下图所示。吸收塔内每吸收11.2L(标准状况)的NO,通过离子交换膜的
再生,装置如下图所示。吸收塔内每吸收11.2L(标准状况)的NO,通过离子交换膜的 的物质的量为
的物质的量为_______ mol。

(5)工业上还可用 溶液吸收烟气中
溶液吸收烟气中 ,发生反应
,发生反应 。其中吸收液pH随溶液中
。其中吸收液pH随溶液中 )变化的关系如表(某温度下):
)变化的关系如表(某温度下):
以下离子浓度关系的判断正确的是_______。
(1)常温下29.4%的硫酸的密度为
(2)常温下,将
(3)通过控制溶液的pH对工业废水中的金属离子进行分离,下图是某些金属氢氧化物在不同浓度和pH时的沉淀—溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于

①
②由图可知
(4)工业上常用连二亚硫酸钠(

(5)工业上还可用
| 91∶9 | 1∶1 | 9∶91 | |
| pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是_______。
| A. |
| B. |
| C.当吸收液呈中性时, |
| D.当吸收液呈中性时, |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网