解答题-原理综合题 适中0.65 引用1 组卷56
对碳的氧化物和氮的氧化物的无害化处理是人类面临的一个重大课题。回答下列问题:
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =___________ kJ·mol-1,若反应III的正反应的活化能为Ea kJ·mol-1 ,则其逆反应的活化能为___________ kJ·mol-1。
②在某容积为2.00L的密闭容器中按照 =1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
=1.00的比值充入一定量NO和CO混合物,在催化剂的作用下,NO的转化率与温度、压强的关系如下图:
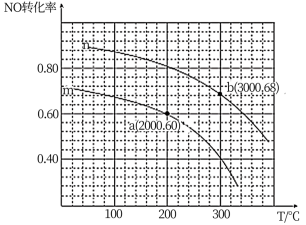
曲线n所代表的压强___________ (填“ >”或“<”)曲线m所代表的压强。测得a点对于反应容器体系中c(CO)=0.10 mol ·L-1,则该条件下容器体系中n(NO) =___________ mol,该温度下平衡常数K=___________ 。
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
CH4(g) +2H2O(g) ΔH,测得CO2的平衡转化率与温度(T)的对应关系如下表:
则ΔH___________ (填“>”或“<”)0,写出提高CO2的平衡转化率的措施有______ (写出1条即可),测得250℃时,平衡体系压强为1.0 ×106 Pa,则平衡常数Kp=______ 。
(1)机动车尾气随意排放会造成CO、NO对大气的污染,尾气中CO、NO的含量是机动车年检的重要指标之一、已知热化学方程式如下:
I.2CO(g) +O2(g)= 2CO2(g) ΔH1= -556.0kJ·mol-1;
Ⅱ.N2(g) +O2(g)= 2NO(g) ΔH2= +180.5 kJ·mol-1 ;
Ⅲ.2NO(g) +2CO(g)=N2(g) +2CO2(g) ΔH3 。
①ΔH3 =
②在某容积为2.00L的密闭容器中按照

曲线n所代表的压强
(2)在容积为1.00 L的密闭容器中,充入4 mol H2和1 mol CO2,发生下列可逆反应:CO2(g) +4H2(g)
| T/℃ | 100 | 150 | 200 | 250 | 300 | 350 |
| 转化率/% | 0.64 | 0.58 | 0.53 | 0.50 | 0.48 | 0.47 |
20-21高二上·湖北·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NO2(g)
2NO2(g)