解答题-结构与性质 适中0.65 引用2 组卷167
碳元素是形成单质及其化合物种类最多的元素,其单质与化合物广泛分布于自然界。碳是地球上组成生命的最基本元素之一,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列有关问题:
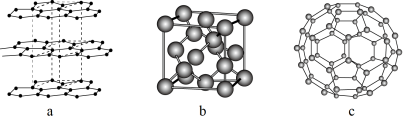
(1)碳元素可形成多种不同形式的单质,如图1是几种碳的单质的结构图:
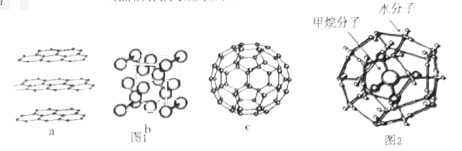
观察上述结构,a对应石墨晶体模型,b对应的物质是金刚石,c是 的分子结构模型。判断b中碳原子的杂化方式为
的分子结构模型。判断b中碳原子的杂化方式为___________ ,在 单质中,微粒之间的作用力为
单质中,微粒之间的作用力为___________ 。
(2) 是制备晴纶的原料,其分子中
是制备晴纶的原料,其分子中 键和
键和 键的个数之比为
键的个数之比为___________ (填最简整数比)。
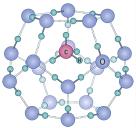
(3)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构, 分子存在于
分子存在于 分子形成的笼子中(如图2所示)。两种分子中,共价键的键能
分子形成的笼子中(如图2所示)。两种分子中,共价键的键能 键
键___________  键(填“大于”或“小于”);
键(填“大于”或“小于”); 分子与
分子与 分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是
分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是___________ 。
(4) 是碳元素的常见氧化物,分子中C原子上有一对孤对电子,
是碳元素的常见氧化物,分子中C原子上有一对孤对电子, 的结构式为
的结构式为 。
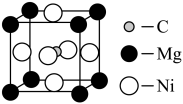
。 可以和很多过渡金属形成配合物。金属镍粉在
可以和很多过渡金属形成配合物。金属镍粉在 气流中轻微地加热,可生成液态的
气流中轻微地加热,可生成液态的 ,用配位键表示
,用配位键表示 的结构为图3;
的结构为图3; 是无色液体,沸点42.1℃,熔点
是无色液体,沸点42.1℃,熔点 ,难溶于水,易溶于有机溶剂,推测
,难溶于水,易溶于有机溶剂,推测 是
是___________ 分子(填“极性”或“非极性”)。 元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态
元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态 原子的电子排布式为:
原子的电子排布式为:___________ ,其位于元素周期表的___________ 区。镍 可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在
可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在___________ (填序号)。
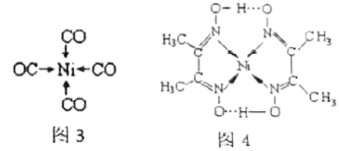
A.氢键 B.离子键 C.共价键 D.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是___________ 。
(1)碳元素可形成多种不同形式的单质,如图1是几种碳的单质的结构图:

观察上述结构,a对应石墨晶体模型,b对应的物质是金刚石,c是
(2)
(3)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,
(4)

A.氢键 B.离子键 C.共价键 D.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是
20-21高二上·山东临沂·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网