解答题-原理综合题 适中0.65 引用1 组卷77
CO2、CO、H2催化合成醇可减排温室气体并合成可再生燃料,是新能源领域的研究前沿。已知CO2与H2混合后一定条件下可发生下列两个可逆反应:
I、CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol−1
II、CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2= 41.1 kJ·mol−1
(1)H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) = CH3OH(g) ΔH,则ΔH=_______ kJ·mol−1。
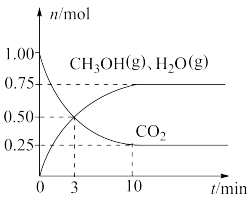
(2)1 mol CO2和3 mol H2混和气体在一定条件下反应,测得CO2平衡转化率、平衡时含碳产物中CH3OH和CO的物质的量分数随温度变化如图-1所示
①图中平衡时产物中CO的百分含量对应的曲线是_______ (填“b”或“c”),理由为_______ 。
②图中X点时,CO2的平衡转化率为25%,则此时混合体系中n(CH3OH)∶n(CO)∶n(CO2)=_______ ;H2的转化率为_______ %(保留三位有效数字)。
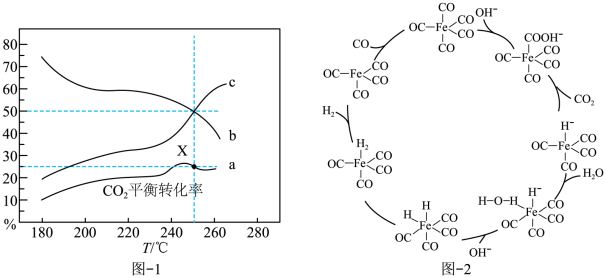
(3)CO和H2O可以在Fe(CO)5催化作用下发生反应II,其反应机理如图-2所示。OH-在此反应中的作用是_______ ;若参与反应的为C18O,则生成的二氧化碳成分为_______ (填“只有CO18O”或“只有CO2” 或“CO18O和CO2”)
I、CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol−1
II、CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2= 41.1 kJ·mol−1
(1)H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) = CH3OH(g) ΔH,则ΔH=
(2)1 mol CO2和3 mol H2混和气体在一定条件下反应,测得CO2平衡转化率、平衡时含碳产物中CH3OH和CO的物质的量分数随温度变化如图-1所示
①图中平衡时产物中CO的百分含量对应的曲线是
②图中X点时,CO2的平衡转化率为25%,则此时混合体系中n(CH3OH)∶n(CO)∶n(CO2)=

(3)CO和H2O可以在Fe(CO)5催化作用下发生反应II,其反应机理如图-2所示。OH-在此反应中的作用是
20-21高二上·江苏扬州·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网