解答题-原理综合题 适中0.65 引用1 组卷45
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)∆H >0 达到平衡时,c(A)=2mol/L、c(B)=7mol/L、c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是
4C(g)∆H >0 达到平衡时,c(A)=2mol/L、c(B)=7mol/L、c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是_______ ;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是_______ 。
A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因(用离子方程式表示)_______ 。
(3)关于小苏打(NaHCO3)溶液的表述错误的是( )
A. c(Na+)=c(HCO )+ c(CO
)+ c(CO )+c(H2CO3)
)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO )+ 2c(CO
)+ 2c(CO )+c(OH-)
)+c(OH-)
C. HCO 的电离程度大于其水解程度
的电离程度大于其水解程度
D. c(Na+)>c(HCO ) >c(OH-)>c(CO
) >c(OH-)>c(CO )
)
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g)
A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因(用离子方程式表示)
(3)关于小苏打(NaHCO3)溶液的表述错误的是
A. c(Na+)=c(HCO
B. c(Na+)+c(H+)=c(HCO
C. HCO
D. c(Na+)>c(HCO
20-21高二上·山西吕梁·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
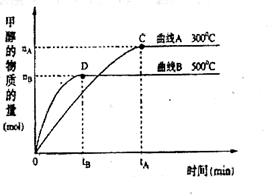
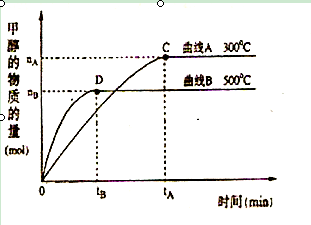
 CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。