解答题-实验探究题 适中0.65 引用2 组卷335
钛白粉 在涂料、油墨等工业中有重要用途.实验室利用金红石(主要成分为
在涂料、油墨等工业中有重要用途.实验室利用金红石(主要成分为 ,含有少量
,含有少量 )制备钛白粉并测定其质量分数的过程如下:
)制备钛白粉并测定其质量分数的过程如下:
I.制备
利用反应 ,在下图装置中制备
,在下图装置中制备 .
.
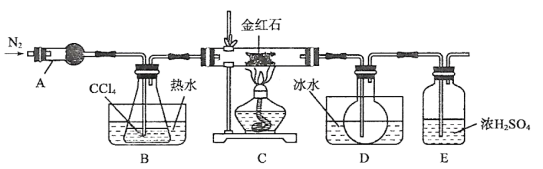
有关物质的性质如下表.
(1)仪器A的名称为___________ .
(2)在组装好仪器之后,首先进行的操作是________ ;装置E的主要作用是__________ ;实验结束后将D中烧瓶内的液态混合物分离的操作名称是_________ .
II.制备钛白粉
在 中加适量水,加热得到沉淀
中加适量水,加热得到沉淀 ,然后过滤、水洗、烘干、焙烧得到钛白粉.
,然后过滤、水洗、烘干、焙烧得到钛白粉.
(3) 水解生成
水解生成 的化学方程式为
的化学方程式为__________ .
III.测定钛白粉中 的质量分数
的质量分数
(4)实验步骤如下:
步骤一:将 钛白粉试样溶于足量热的硫酸,在隔绝空气的条件下加入过量的铝粉将
钛白粉试样溶于足量热的硫酸,在隔绝空气的条件下加入过量的铝粉将 还原为
还原为 后过滤;
后过滤;
步骤二:配制 硫酸铁铵标准溶液.称取48.2g硫酸铁铵
硫酸铁铵标准溶液.称取48.2g硫酸铁铵 于适量的稀硫酸中加热溶解,_____________,用蒸馏水洗涤烧杯与玻璃棒2~3次,并将洗涤液全部注入容量瓶中,向容量瓶中加蒸馏水至离刻度线1~2cm处,____________,再将容量瓶塞好瓶塞,反复上下颠倒,摇匀.
于适量的稀硫酸中加热溶解,_____________,用蒸馏水洗涤烧杯与玻璃棒2~3次,并将洗涤液全部注入容量瓶中,向容量瓶中加蒸馏水至离刻度线1~2cm处,____________,再将容量瓶塞好瓶塞,反复上下颠倒,摇匀.
步骤三:加入几滴 溶液作指示剂,用配制的
溶液作指示剂,用配制的 标准溶液滴定至终点(将
标准溶液滴定至终点(将 氧化为
氧化为 ),消耗
),消耗 溶液的体积
溶液的体积 .
.
①补齐步骤二中实验操作________ 、__________ .
②钛白粉试样中所含 的质量分数表达式为
的质量分数表达式为___________ .
③下列关于测定结果的分析,说法正确的是_______ (填字母).
a.若钛白粉中含有少量铁元素,将导致测定结果偏低
b.若步骤二中未洗涤烧杯和玻璃棒,将导致测定结果偏低
c.若步骤三滴定过程中速度过慢,将导致测定结果偏低
I.制备
利用反应

有关物质的性质如下表.
| 物质 | 熔点/C | 沸点/℃ | 其它 |
| 76 | 与 | ||
| 136 | 遇潮湿空气产生白雾 | ||
| 57.6 | 遇潮湿空气产生白雾 |
(2)在组装好仪器之后,首先进行的操作是
II.制备钛白粉
在
(3)
III.测定钛白粉中
(4)实验步骤如下:
步骤一:将
步骤二:配制
步骤三:加入几滴
①补齐步骤二中实验操作
②钛白粉试样中所含
③下列关于测定结果的分析,说法正确的是
a.若钛白粉中含有少量铁元素,将导致测定结果偏低
b.若步骤二中未洗涤烧杯和玻璃棒,将导致测定结果偏低
c.若步骤三滴定过程中速度过慢,将导致测定结果偏低
21-22高三上·山东滨州·期末
类题推荐  和
和 都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
①制备 。
。
实验室利用反应 ,在无水无氧条件下制备
,在无水无氧条件下制备 ,装置图和有关信息如下:
,装置图和有关信息如下:
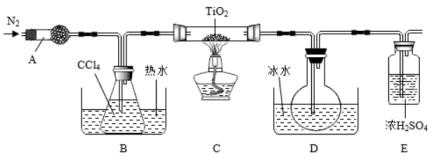
请回答下列问题:
(1)仪器B中盛装 的仪器名称是
的仪器名称是___________ 。
(2)请补充完整实验步骤:①组装仪器,②检查装置气密性,③加装药品,④___________ ,⑤点燃酒精灯,⑥停止加热,⑦停止通 。
。
(3)实验结束后需要分离D中的液态混合物,该操作使用的主要玻璃仪器有___________ (写2个即可)。
Ⅱ.制备并测定的质量分数。
在 中加水、加热,水解得到沉淀
中加水、加热,水解得到沉淀 ,经过滤、水洗,再烘干、焙烧除去水分得到粉体。
,经过滤、水洗,再烘干、焙烧除去水分得到粉体。
(4)一定条件下,将 溶解并还原为
溶解并还原为 ,用
,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。滴定分析时,称取上述
。滴定分析时,称取上述 试样0.2g,消耗
试样0.2g,消耗 标准溶液20mL。则
标准溶液20mL。则 质量分数为
质量分数为___________ 。
(5)配制 标准溶液时,加入一定量
标准溶液时,加入一定量 的目的是抑制
的目的是抑制 水解,现在实验室中有一瓶98%的H2SO4(
水解,现在实验室中有一瓶98%的H2SO4( ),要配制2.0mol/L的稀
),要配制2.0mol/L的稀 ,请回答如下问题:需要量筒量取浓硫酸的体积为
,请回答如下问题:需要量筒量取浓硫酸的体积为___________ 。在该配置实验使用的玻璃仪器中有___________ 种(填阿拉伯数字)。
(6)在用浓硫酸配制稀硫酸过程中,下列操作中会造成稀硫酸溶液质量分数偏小的共有___________ 个(填阿拉伯数字)。
A.在稀释时,未恢复至室温就转移入容量瓶
B.在稀释过程中,有少量液体溅出
C.在转移过程中,烧杯和玻璃棒没有进行洗涤
D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线相平
E.用量筒量取一定体积的浓硫酸时,仰视读数
钛白粉(TiO2)在涂料、油墨等工业中有重要用途。实验室利用金红石(主要成分为TiO2,含少量SiO2杂质)制备钛白粉并测定其质量分数的过程如下:
已知:①TiO2是白色粉末,不溶于水和稀酸,溶于氢氟酸和热的浓硫酸;Ti3+在空气中容易被氧化。
②有关物质的性质如下表。
Ⅰ. 制备TiCl4:
利用反应TiO2 (s)+CCl4(g) TiCl4(g)+CO2(g),在下图装置中制备TiCl4。
TiCl4(g)+CO2(g),在下图装置中制备TiCl4。
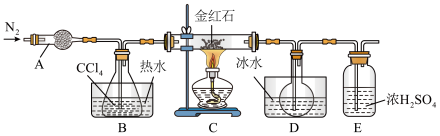
(1)实验过程中的操作包括:①组装仪器,②____ ;③加装药品;④通N2一段时间;⑤最后点燃酒精灯……。实验结束后欲分离D中烧瓶内的液态混合物,所采用操作的名称是____________ 。
(2)装置E的主要作用是__________ 。
(3)若用反应TiO2(s)+2C(s)+2Cl2(g) TiCl4(g)+2CO(g) 制取TiCl4,可将上述实验作如下改变:①将通N2改为通Cl2;②撤去装置B;③石英管内改为盛TiO2和C;④
TiCl4(g)+2CO(g) 制取TiCl4,可将上述实验作如下改变:①将通N2改为通Cl2;②撤去装置B;③石英管内改为盛TiO2和C;④____ ;⑤增加CO的吸收装置。
Ⅱ. 制备钛白粉:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗、烘干、焙烧除去水分得到钛白粉。
(4)写出水解生成TiO2·xH2O的化学方程式_______ 。
Ⅲ. 测定钛白粉中TiO2的质量分数:
(5)某研究小组欲测定制得的钛白粉中TiO2的质量分数,实验步骤如下:
步骤一:将a g钛白粉试样溶于足量热的硫酸;在隔绝空气的条件下加入过量的铝粉将Ti4+还原为Ti3+后过滤;
步骤二:配制0.100 mol·L-1 1000 mL硫酸铁铵标准溶液。称取48.2 g硫酸铁铵[NH4Fe (SO4)2·12H2O]于适量的稀硫酸中加热溶解, ,塞好瓶塞,反复颠倒摇匀。
步骤三:加入几滴KSCN溶液作指示剂,用配制的NH4Fe(SO4)2标准溶液滴定(将Ti3+氧化为Ti4+),至终点时消耗NH4Fe(SO4)2溶液的体积V mL。
①补齐步骤二中实验步骤____ 。
②钛白粉试样中所含(TiO2)的质量分数表达式为____ 。
③下列关于测定过程的分析,说法正确的是____ (填字母)。
a.若钛白粉中含有少量铁元素,将导致测定结果偏高
b.若步骤三滴定过程中速度过慢,将导致结果偏低
c.若步骤三中所用的酸式滴定管未用NH4Fe(SO4)2标准溶液润洗,则测得样品中Ti元素含量偏高
已知:①TiO2是白色粉末,不溶于水和稀酸,溶于氢氟酸和热的浓硫酸;Ti3+在空气中容易被氧化。
②有关物质的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 其它 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
SiCl4 | -70 | 57.6 | 遇潮湿空气产生白雾 |
利用反应TiO2 (s)+CCl4(g)

(1)实验过程中的操作包括:①组装仪器,②
(2)装置E的主要作用是
(3)若用反应TiO2(s)+2C(s)+2Cl2(g)
Ⅱ. 制备钛白粉:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗、烘干、焙烧除去水分得到钛白粉。
(4)写出水解生成TiO2·xH2O的化学方程式
Ⅲ. 测定钛白粉中TiO2的质量分数:
(5)某研究小组欲测定制得的钛白粉中TiO2的质量分数,实验步骤如下:
步骤一:将a g钛白粉试样溶于足量热的硫酸;在隔绝空气的条件下加入过量的铝粉将Ti4+还原为Ti3+后过滤;
步骤二:配制0.100 mol·L-1 1000 mL硫酸铁铵标准溶液。称取48.2 g硫酸铁铵[NH4Fe (SO4)2·12H2O]于适量的稀硫酸中加热溶解, ,塞好瓶塞,反复颠倒摇匀。
步骤三:加入几滴KSCN溶液作指示剂,用配制的NH4Fe(SO4)2标准溶液滴定(将Ti3+氧化为Ti4+),至终点时消耗NH4Fe(SO4)2溶液的体积V mL。
①补齐步骤二中实验步骤
②钛白粉试样中所含(TiO2)的质量分数表达式为
③下列关于测定过程的分析,说法正确的是
a.若钛白粉中含有少量铁元素,将导致测定结果偏高
b.若步骤三滴定过程中速度过慢,将导致结果偏低
c.若步骤三中所用的酸式滴定管未用NH4Fe(SO4)2标准溶液润洗,则测得样品中Ti元素含量偏高
①制备
实验室利用反应

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| -23 | 76 | 与TiCl4互溶 | |
| -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器B中盛装
(2)请补充完整实验步骤:①组装仪器,②检查装置气密性,③加装药品,④
(3)实验结束后需要分离D中的液态混合物,该操作使用的主要玻璃仪器有
Ⅱ.制备并测定的质量分数。
在
(4)一定条件下,将
(5)配制
(6)在用浓硫酸配制稀硫酸过程中,下列操作中会造成稀硫酸溶液质量分数偏小的共有
A.在稀释时,未恢复至室温就转移入容量瓶
B.在稀释过程中,有少量液体溅出
C.在转移过程中,烧杯和玻璃棒没有进行洗涤
D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线相平
E.用量筒量取一定体积的浓硫酸时,仰视读数
TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
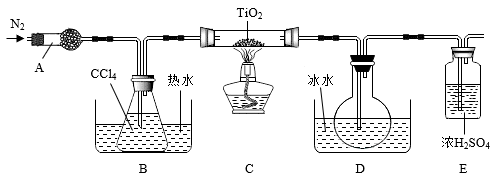
请回答下列问题:
(1)仪器A的名称是___________ 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃酒精灯,⑥停止通N2 ,⑦停止加热。正确的操作顺序是___________ 。实验结束后欲分离D中的液态混合物,所采用操作的名称是___________ 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(3)写出生成TiO2·xH2O的化学方程式___________ 。
(4)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL。
①则TiO2质量分数为___________ 。(相对原子量Ti-48)
②配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是抑制NH4Fe(SO4)2水解。
现在实验室中有一瓶98%的H2SO4 (ρ=1.84g/cm3) ,要配制2.0mol/L的稀H2SO4 250mL,请回答如下问题:需要量筒量取浓硫酸的体积为___________ 。在该实验使用的玻璃仪器中除烧杯、玻璃棒、量筒外,还有___________ 。
③在用浓硫酸配制稀硫酸过程中,下列操作中会造成稀硫酸溶液质量分数偏小的是___________ (填字母)。
A.在稀释时,未恢复至室温就转移入容量瓶
B.在稀释过程中,有少量液体溅出
C.在转移过程中,烧杯和玻璃棒没有进行洗涤
D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线相平
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃酒精灯,⑥停止通N2 ,⑦停止加热。正确的操作顺序是
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(3)写出生成TiO2·xH2O的化学方程式
(4)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL。
①则TiO2质量分数为
②配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是抑制NH4Fe(SO4)2水解。
现在实验室中有一瓶98%的H2SO4 (ρ=1.84g/cm3) ,要配制2.0mol/L的稀H2SO4 250mL,请回答如下问题:需要量筒量取浓硫酸的体积为
③在用浓硫酸配制稀硫酸过程中,下列操作中会造成稀硫酸溶液质量分数偏小的是
A.在稀释时,未恢复至室温就转移入容量瓶
B.在稀释过程中,有少量液体溅出
C.在转移过程中,烧杯和玻璃棒没有进行洗涤
D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线相平
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


