计算题 适中0.65 引用1 组卷223
(1)已知C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1则0.5 mol丙烷完全燃烧释放的热量为___________ kJ。
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1,2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ·mol-1,写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:___________
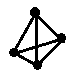
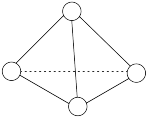
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似,化学性质比较活泼。已知断裂1 mol N—N键吸收193 kJ热量,断裂1mol N≡N键吸收941 kJ热量,断裂1 mol N—H键吸收391 kJ热量,断裂1 mol H—H键吸收436 kJ热量,则:
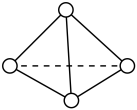
①1 mol N4气体转化为2 mol N2时要放出___________ kJ能量。
②写出N4与H2反应生成NH3的热化学方程式:___________ 。
(4)已知:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。下列反应中能放出57.3 kJ热量的是__________ 。
a.1 L 1 mol·L-1的稀H2SO4与足量NaOH溶液反应
b.稀盐酸与氨水反应生成1 mol H2O
c.稀盐酸与稀Ba(OH)2溶液反应生成1 mol 水
d.稀NaOH与95%浓硫酸反应生成1 mol 水
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1,2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ·mol-1,写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似,化学性质比较活泼。已知断裂1 mol N—N键吸收193 kJ热量,断裂1mol N≡N键吸收941 kJ热量,断裂1 mol N—H键吸收391 kJ热量,断裂1 mol H—H键吸收436 kJ热量,则:

①1 mol N4气体转化为2 mol N2时要放出
②写出N4与H2反应生成NH3的热化学方程式:
(4)已知:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。下列反应中能放出57.3 kJ热量的是
a.1 L 1 mol·L-1的稀H2SO4与足量NaOH溶液反应
b.稀盐酸与氨水反应生成1 mol H2O
c.稀盐酸与稀Ba(OH)2溶液反应生成1 mol 水
d.稀NaOH与95%浓硫酸反应生成1 mol 水
19-20高二上·海南海口·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
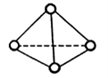 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN