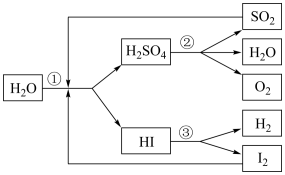
解答题-工业流程题 适中0.65 引用1 组卷117
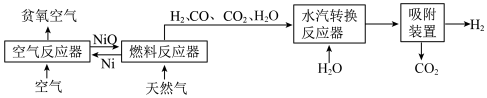
自热化学链重整制氢 工艺的原理如图所示:
工艺的原理如图所示:
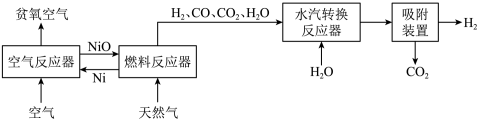
回答下列问题:
(1)25℃、101 时,5.9g
时,5.9g 与足量
与足量 反应生成
反应生成 放出47.2
放出47.2 的热量,则在“空气反应器”中发生反应的热化学方程式为
的热量,则在“空气反应器”中发生反应的热化学方程式为_______ 。
(2)“燃料反应器”中发生的部分反应有:
(Ⅰ)
(Ⅱ)
(Ⅲ)
则反应 的
的
_______  。
。
(3)“水汽转换反应器”中发生的反应为 (平衡常数
(平衡常数 ),将天然气看作是纯净的
),将天然气看作是纯净的 (假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻
(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻 、
、 、
、 、
、 浓度之比为
浓度之比为 此时
此时
_______  (填“>”、“=”或“<”),理由是
(填“>”、“=”或“<”),理由是_______ 。
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等, 工艺重整是一种联合重整,涉及反应的热化学方程式如下:
工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应:
部分氧化重整反应:
采用水蒸气重整的优点是_______ ;若上述两个反应在保持自热条件下(假设无热量损失),理论上1 至多可获得
至多可获得 的物质的量为
的物质的量为_______ (结果保留1位小数)。

回答下列问题:
(1)25℃、101
(2)“燃料反应器”中发生的部分反应有:
(Ⅰ)
(Ⅱ)
(Ⅲ)
则反应
(3)“水汽转换反应器”中发生的反应为
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,
水蒸气重整反应:
部分氧化重整反应:
采用水蒸气重整的优点是
20-21高二上·湖北随州·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网