解答题-原理综合题 适中0.65 引用2 组卷805
已知CaCrO4微溶于水,某传统测定CaCrO4溶度积的实验如下:
①配制250 mL待标定的K2CrO4溶液。
②标定测得K2CrO4溶液浓度为0.6025 mol/L。
③按下表数据将0.2000 mol/LCaCl2溶液、K2CrO4溶液及蒸馏水混匀,静置(溶液体积变化忽略不计)。
④取上层清液于锥形瓶中,加入H2SO4和H3PO4溶液酸化,溶液由黄色转变为橙色,加入指示剂,用0.2000 mol/L(NH4)2Fe(SO4)2溶液滴定,数据记入下表。
⑤滴定测出上层清液中的c( ),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。
),进而计算出上层清液中的c(Ca2+),即得Ksp(CaCrO4)。
回答下列问题:
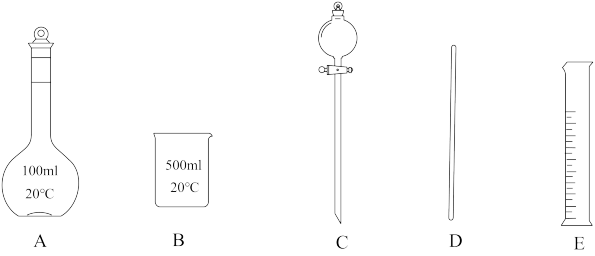
(1)步骤①中无需使用下列哪些仪器_______ (填标号)。
(2)基态Cr原子的电子排布式为_______ 。
(3)步骤④中所得橙色溶液中铬元素的主要存在形式为_______ (填化学式);滴定时还原产物为Cr3+,写出反应的离子方程式_______ 。
(4) 根据第2组滴定数据,计算得上层清液中c( )=
)=_______ mol/L。
(5)滴定时,有一组数据出现了明显异常,所测c( )偏大,原因可能有
)偏大,原因可能有_______ (填标号)。
A.滴定终点读数时仰视刻度线 B.达终点时滴定管尖嘴有标准液悬挂
C.盛装待测液的锥形瓶未润洗 D.摇动锥形瓶时有液体溅出
(6)利用上表数据经计算绘制出如下图点,请根据图点绘出溶度积曲线_________ 。
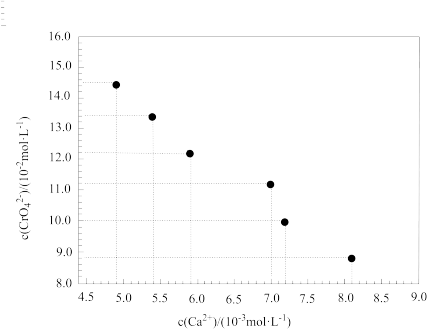
(7)请结合图线推测Ksp(CaCrO4)≈_______ (保留两位有效数字)。
①配制250 mL待标定的K2CrO4溶液。
②标定测得K2CrO4溶液浓度为0.6025 mol/L。
③按下表数据将0.2000 mol/LCaCl2溶液、K2CrO4溶液及蒸馏水混匀,静置(溶液体积变化忽略不计)。
④取上层清液于锥形瓶中,加入H2SO4和H3PO4溶液酸化,溶液由黄色转变为橙色,加入指示剂,用0.2000 mol/L(NH4)2Fe(SO4)2溶液滴定,数据记入下表。
组别 体积(mL) 物质 | 1 | 2 | 3 | 4 | 5 | 6 |
CaCl2 | 25.00 | 25.00 | 25.00 | 25.00 | 25.00 | 25.00 |
K2CrO4 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 |
蒸馏水 | 10.00 | 9.00 | 8.00 | 7.00 | 6.00 | 5.00 |
取上层清液 | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
耗(NH4)2Fe(SO4)2 | 13.33 | 15.00 | 16.78 | 18.42 | 20.15 | 21.89 |
回答下列问题:
(1)步骤①中无需使用下列哪些仪器

(2)基态Cr原子的电子排布式为
(3)步骤④中所得橙色溶液中铬元素的主要存在形式为
(4) 根据第2组滴定数据,计算得上层清液中c(
(5)滴定时,有一组数据出现了明显异常,所测c(
A.滴定终点读数时仰视刻度线 B.达终点时滴定管尖嘴有标准液悬挂
C.盛装待测液的锥形瓶未润洗 D.摇动锥形瓶时有液体溅出
(6)利用上表数据经计算绘制出如下图点,请根据图点绘出溶度积曲线

(7)请结合图线推测Ksp(CaCrO4)≈
2021·辽宁·模拟预测
类题推荐
按要求填空:
I.
(1)AlCl3的水溶液pH_______ 7 ( 填>、=、<),其原因为_______ (用离子方程式表示),将其溶液加热蒸干并灼烧最终得到的物质是_______ (填化学式)。
(2)常温下,Cr(OH)3的溶度积Ksp= c(Cr3+)∙c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______ 。
(3)物质的量浓度相同的三种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4,c( )大小顺序是
)大小顺序是_______ (用序号表示)
(4)常温下两种溶液:a.pH=4的NH4Cl b.pH=4的盐酸,其中水电离出的c(H+)之比为_______ 。
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol/LHA溶液中逐滴加入0.1000mol/L的标准KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
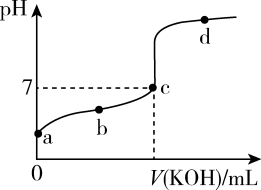
(5)a、b、c、d四点中水的电离程度最大的是_______ 点,滴定过程中宜选用_______ 作指示剂,滴定终点在_______  填“c点以上”或“c点以下”
填“c点以上”或“c点以下” 。
。
(6)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_______。
(7)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_______ mol/L。 保留
保留 位有效数字
位有效数字
I.
(1)AlCl3的水溶液pH
(2)常温下,Cr(OH)3的溶度积Ksp= c(Cr3+)∙c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
(3)物质的量浓度相同的三种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4,c(
(4)常温下两种溶液:a.pH=4的NH4Cl b.pH=4的盐酸,其中水电离出的c(H+)之比为
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol/LHA溶液中逐滴加入0.1000mol/L的标准KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

(5)a、b、c、d四点中水的电离程度最大的是
(6)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_______。
| A.滴定前碱式滴定管未用标准KOH溶液润洗 |
| B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定 |
| C.滴定过程中,溶液出现变色后,立即停止滴定 |
| D.滴定结束后,仰视液面,读取KOH溶液体积 |
| 实验序号 | KOH溶液体积/mL | 待测HA溶液体积/mL |
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,要进行必要的处理。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3 2NaI+Na2S4O6)
2NaI+Na2S4O6)
步骤Ⅳ:将上述反应后溶液进行pH调节、过滤等处理,回收沉淀,滤液倒入下水道。
(1)步骤Ⅰ加入稀硫酸酸化的目的是_____________________________ ;
(2)步骤Ⅱ判断滴定达到终点的现象是___________________________ ;
(3)以下操作会造成废水中铬含量测定值偏高的是_________________ ;
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72-的物质的量为___________ mol.
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:
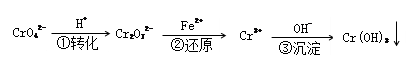
(5)能说明第①步反应达到平衡状态的是_____________ ;(填字母代号)
a. Cr2O72-和CrO42-的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要________ mol的FeSO4·7H2O。
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至___________ 。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
第一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | 18.20 |
(1)步骤Ⅰ加入稀硫酸酸化的目的是
(2)步骤Ⅱ判断滴定达到终点的现象是
(3)以下操作会造成废水中铬含量测定值偏高的是
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72-的物质的量为
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:

(5)能说明第①步反应达到平衡状态的是
a. Cr2O72-和CrO42-的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网