解答题-结构与性质 适中0.65 引用0 组卷852
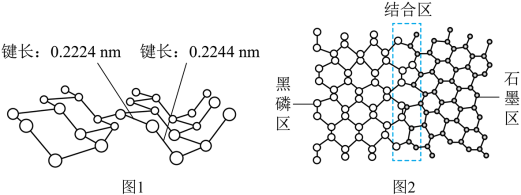
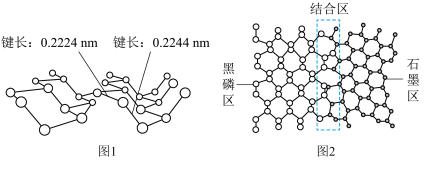
磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(图1)。 为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。
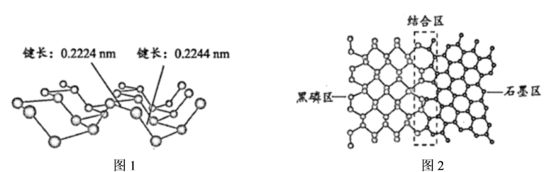
回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是_________________ (用元素符号作答)。
(2)基态磷原子价电子排布式为________________ 。
(3)图2黑磷区中P原子的杂化方式为_________________ ,石墨区中C原子的杂化方式为____________ 。
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为________________ 。
(5)根据图1和图2的信息,下列说法正确的有________ (填字母)。
A. 黑磷区中P-P键的键能不完全相同
B. 黑磷与石墨都属于混合型晶体
C. 由石墨与黑磷制备该复合材料的过程,发生了化学反应
D. 石墨与黑磷的交界结合区域中,P原子与C原子共平面
E. 复合材料单层中,P原子与C原子之间的作用力属范德华力
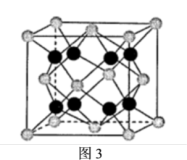
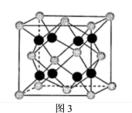
(6)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为___________________ , 晶体的密度为__________ g·cm-3(列出计算式)。

回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是
(2)基态磷原子价电子排布式为
(3)图2黑磷区中P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为
(5)根据图1和图2的信息,下列说法正确的有
A. 黑磷区中P-P键的键能不完全相同
B. 黑磷与石墨都属于混合型晶体
C. 由石墨与黑磷制备该复合材料的过程,发生了化学反应
D. 石墨与黑磷的交界结合区域中,P原子与C原子共平面
E. 复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

类题推荐
VA族元素及其化合物在生产、生活中用途广泛。
(1)苯胺( )的晶体类型是
)的晶体类型是___________ 。苯胺与甲苯(  )的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95.0℃)、沸点(110.6℃),原因是___________ 。
(2)两种氧化物的熔点如表所示:解释表中氧化物之间熔点差异的原因___________ 。
(3)①白磷在氯气中燃烧可以得到 和
和 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为 ___________ 。
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为 和
和 ,分析PCl5和PBr5结构存在差异的原因是
,分析PCl5和PBr5结构存在差异的原因是 ___________ 。
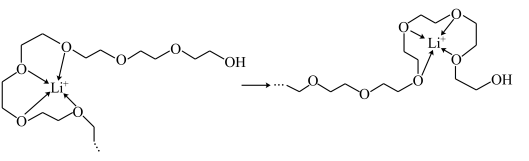
(4) 乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___________ ,其中与乙二胺形成的化合物稳定性相对较高的是___________ (Mg2+或Cu2+)。
(5) 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷——石墨复合负极材料,其单层结构俯视图如图2所示。
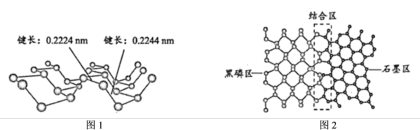
根据图1和图2的信息,下列说法正确的有___________ (填字母)。
A.黑磷区中P-P键的键能不完全相同
B.黑磷与石墨都属于混合型晶体
C.由石墨与黑磷制备该复合材料的过程,发生了化学反应
D.石墨与黑磷的交界结合区域中,P原子与C原子共平面
E.复合材料单层中,P原子与C原子之间的作用力属范德华力
(5)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为a nm,晶体中与P距离最近的Rh的数目为___________ ,晶体的密度为___________ g·cm-3 (列出计算式)。
(1)苯胺(
 )的晶体类型是
)的晶体类型是 )的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95.0℃)、沸点(110.6℃),原因是(2)两种氧化物的熔点如表所示:解释表中氧化物之间熔点差异的原因
| 氧化物 | SO2 | P4O6 |
| 熔点/℃ | ﹣75.5 | 23.8 |
(3)①白磷在氯气中燃烧可以得到
②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为
(4) 乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是
(5) 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷——石墨复合负极材料,其单层结构俯视图如图2所示。


根据图1和图2的信息,下列说法正确的有
A.黑磷区中P-P键的键能不完全相同
B.黑磷与石墨都属于混合型晶体
C.由石墨与黑磷制备该复合材料的过程,发生了化学反应
D.石墨与黑磷的交界结合区域中,P原子与C原子共平面
E.复合材料单层中,P原子与C原子之间的作用力属范德华力
(5)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为a nm,晶体中与P距离最近的Rh的数目为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网