解答题-原理综合题 较难0.4 引用9 组卷2428
温室气体的利用是当前环境和能源领域的研究热点。
I.CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①CH4(g) + CO2(g)⇌2CO(g)+2H2 (g) ΔH1
反应②CO2 (g)+ H2 (g)⇌CO(g) + H2O(g) ΔH2= +41.2 kJ·mol-1
反应③CH4 (g)+ O2(g)⇌CO(g) + 2H2(g) ΔH3 = -35.6 kJ·mol-1
O2(g)⇌CO(g) + 2H2(g) ΔH3 = -35.6 kJ·mol-1
(1)已知: O 2(g)+H2(g)= H2O(g) ΔH = -241.8 kJ·mol-1,则ΔH1 =
O 2(g)+H2(g)= H2O(g) ΔH = -241.8 kJ·mol-1,则ΔH1 =______ kJ·mol-1。
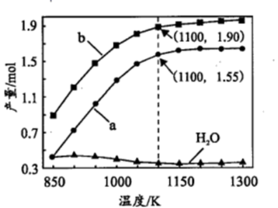
(2)一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0 mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示。
①图中a和b分别代表产物______ 和______ ,当温度高于900 K, H2O的含量随温度升高而下降的主要原因是______ 。
②1100 K时,CH4与CO2的转化率分别为95%和90%,反应①的平衡常数K=______ ( 写出计算式)。
II.Ni-CeO2催化CO2加H2形成CH4的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图2所示。

(3)下列对CO2甲烷化反应体系的说法合理的有______ 。
A.含碳副产物的产率均低于CH4
B.存在反应CO2+4H2⇌CH4 + 2H2O
C.存在副反应CO2+ H2⇌CO+ H2O
D. CO2 转化为CH4的过程中发生了能量转化
E.温度高于260℃后,升高温度,甲烷产率几乎不变
(4) CO2甲烷化的过程中,保持CO2与H2的体积比为1:4,反应气的总流量控制在40 mL·min-1,320 ℃时测得CO2转化率为80%,则CO2反应速率为______ mL·min-1。
I.CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应①CH4(g) + CO2(g)⇌2CO(g)+2H2 (g) ΔH1
反应②CO2 (g)+ H2 (g)⇌CO(g) + H2O(g) ΔH2= +41.2 kJ·mol-1
反应③CH4 (g)+
(1)已知:
(2)一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0 mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示。

①图中a和b分别代表产物
②1100 K时,CH4与CO2的转化率分别为95%和90%,反应①的平衡常数K=
II.Ni-CeO2催化CO2加H2形成CH4的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图2所示。

(3)下列对CO2甲烷化反应体系的说法合理的有
A.含碳副产物的产率均低于CH4
B.存在反应CO2+4H2⇌CH4 + 2H2O
C.存在副反应CO2+ H2⇌CO+ H2O
D. CO2 转化为CH4的过程中发生了能量转化
E.温度高于260℃后,升高温度,甲烷产率几乎不变
(4) CO2甲烷化的过程中,保持CO2与H2的体积比为1:4,反应气的总流量控制在40 mL·min-1,320 ℃时测得CO2转化率为80%,则CO2反应速率为
2021·广东·模拟预测
类题推荐
温室气体的利用是当前环境和能源领域的研究热点,合理利用燃料废气中的CO2,也是实现“碳中和”的途径之一、回答下列问题:
(1)CO2与CH4重整可以同时利用两种温室气体,过程中涉及如下反应:
I.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247.41kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.41kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
Ⅲ.CH4(g)+ O2(g)
O2(g)  CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
CO(g)+2H2(g) ΔH3=-35.6kJ·mol-1
①已知: O2(g)+H2(g)=H2O(g) ΔH=-241.8kJ·mol-1,则ΔH2=
O2(g)+H2(g)=H2O(g) ΔH=-241.8kJ·mol-1,则ΔH2=___________ kJ·mol-1。
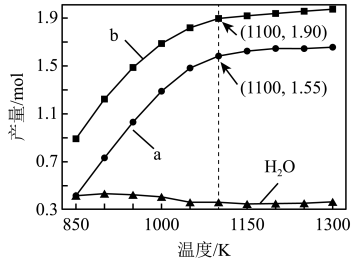
②一定条件下,向体积为V L的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示,x曲线代表___________ (填化学式)产量变化,1100K时,CH4与CO2的转化率分别为95%和90%,反应I的平衡常数K=___________ (mol·L-1)2(写出计算式,用含a、b、V的代数式表示)。
I.CO2(g)+H2(g) HCOOH(g) ΔH1<0
HCOOH(g) ΔH1<0
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
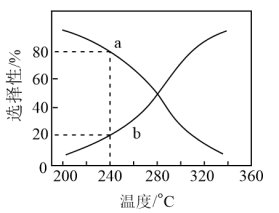
刚性容器中CO2(g)和H2(g)按物质的量1:1投料,平衡时HCOOH和CO的选择性随温度变化如图所示。___________ ,为同时提高CO2的平衡转化率和平衡时HCOOH的选择性,应选择的反应条件为___________ (填标号)。
A.低温、低压 B.高温、高压
C.高温、低压 D.低温、高压
②240℃时,容器内压强随温度的变化如下表:
反应I的速率可表示为v=k·p(CO2)·p(H2)(k为常数),则反应在60min时v=___________ (用含p0、k的式子表示)。
(1)CO2与CH4重整可以同时利用两种温室气体,过程中涉及如下反应:
I.CH4(g)+CO2(g)
Ⅱ.CO2(g)+H2(g)
Ⅲ.CH4(g)+
①已知:
②一定条件下,向体积为V L的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示,x曲线代表
I.CO2(g)+H2(g)
II.CO2(g)+H2(g)
刚性容器中CO2(g)和H2(g)按物质的量1:1投料,平衡时HCOOH和CO的选择性随温度变化如图所示。
A.低温、低压 B.高温、高压
C.高温、低压 D.低温、高压
②240℃时,容器内压强随温度的变化如下表:
| 时间/ min | 0 | 20 | 40 | 60 | 80 |
| 压强/ MPa | P0 | 0.91 P0 | 0.85 P0 | 0.80 P0 | 0.80 P0 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网