解答题-实验探究题 较难0.4 引用5 组卷1817
试剂级NaCl可用海盐(含泥沙、海藻、K+、 Ca2+、 Mg2+、Fe3+、SO 等杂质)为原料制备。制备流程简图如下:
等杂质)为原料制备。制备流程简图如下:
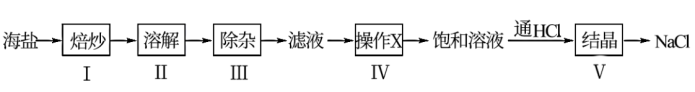
(1)焙炒海盐的目的是______ 。
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
(3)操作X为______ 。
(4)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
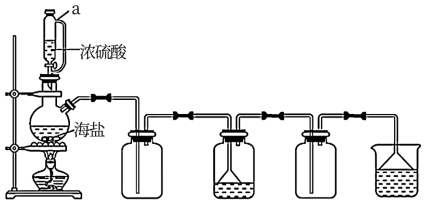
①试剂a为______ 。 相比分液漏斗,选用仪器1的优点是______ 。
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是______ 。
(5)已知:CrO + Ba2+ = BaCrO4↓(黄色)
+ Ba2+ = BaCrO4↓(黄色)
CrO +3Fe2++ 8H+ =Cr3+ + 3Fe3++ 4H2O
+3Fe2++ 8H+ =Cr3+ + 3Fe3++ 4H2O
设计如下实验测定NaCl产品中SO 的含量,填写下列表格。
的含量,填写下列表格。

(1)焙炒海盐的目的是
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | BaCl2溶液 | SO |
| 步骤2 | ||
| 步骤3 |
(4)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①试剂a为
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是
(5)已知:CrO
CrO
设计如下实验测定NaCl产品中SO
| 操作 | 现象 | 目的/结论 | |
| ① | 称取样品m1g,加水溶解,加盐酸调至弱酸性,滴加过量c1mol·L-1BaCl2溶液V1mL | 稍显浑浊 | 目的: |
| ② | 继续滴加过量c2mol ·L-1 K2CrO4溶液V2 mL | 产生黄色沉淀 | 目的:沉淀过量的Ba2+。 |
| ③ | 过滤洗涤,滴加少许指示剂于滤液中,用c3 mol·L-1FeSO4溶液滴定至终点,消耗FeSO4溶液V3 mL | —— | 结论:SO |
2021·广东·模拟预测
类题推荐
实验室使用的纯度较高的NaCl可用含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、 等杂质的海盐为原料制备,实验室模拟工业制备流程如下图
等杂质的海盐为原料制备,实验室模拟工业制备流程如下图
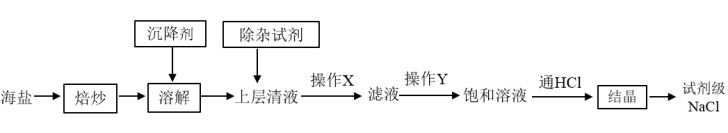
(1)焙炒海盐的目的是___________
(2)溶解时,为吸附水中的悬浮物应加入沉降剂,下列哪种沉降剂最佳___________
A.明矾B.硫酸铁C.硫酸铝D.氯化铁
(3)操作X为___________
(4)根据除杂原理,在下表中填写除杂时依次添加的试剂及预期沉淀的离子。
(5)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
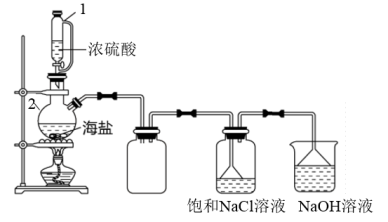
①写出制备HCl气体的化学反应方程式(产物之一为正盐)___________
②相比分液漏斗,选用仪器1的优点是___________
③写出仪器2的名称___________
④盛放NaOH溶液的烧杯的用途是___________
(6)已知 ;
; 设计如下实验测定NaCl产品中
设计如下实验测定NaCl产品中 的含量,填写下列表格。
的含量,填写下列表格。

(1)焙炒海盐的目的是
(2)溶解时,为吸附水中的悬浮物应加入沉降剂,下列哪种沉降剂最佳
A.明矾B.硫酸铁C.硫酸铝D.氯化铁
(3)操作X为
(4)根据除杂原理,在下表中填写除杂时依次添加的试剂及预期沉淀的离子。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | NaOH溶液 | Mg2+、Fe3+ |
| 步骤2 | ||
| 步骤3 |
(5)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①写出制备HCl气体的化学反应方程式(产物之一为正盐)
②相比分液漏斗,选用仪器1的优点是
③写出仪器2的名称
④盛放NaOH溶液的烧杯的用途是
(6)已知
| 操作 | 现象 | 目的/结论 |
| 称取样品m1g加水溶解,加盐酸调至弱酸性,滴加过最c1 mol·L-1BaCl2溶液V1mL | 稍显浑浊 | 目的: |
| 继续滴加过量c2 mol·L-1K2CrO4溶液V2 mL | 黄色沉淀 | 目的:沉淀过量的Ba2+ |
| 过滤洗涤,将魂液加水至200.00mL,取25.00mL滤液于锥形瓶中,用c3 mol·L-1FeSO4溶液滴定3次。平均消耗FeSO4溶液V3 mL. | 结论:测定 | |
| 若某次滴定,FeSO4溶液不小心溅出2滴。 | 计算得到的 |
试剂级 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程简图如下:
等杂质)为原料制备。制备流程简图如下:

(1)焙炒海盐的目的是_______ 。
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
(3)操作X为_______ 。
(4)已知: (黄色)、
(黄色)、
设计如下实验测定 产品中
产品中 的含量,填写下列表格。
的含量,填写下列表格。

(1)焙炒海盐的目的是
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | ||
| 步骤2 | ||
| 步骤3 |
(4)已知:
设计如下实验测定
| 操作 | 现象 | 目的/结论 | |
| ① | 称取样品 | 稍显浑浊 | 目的: |
| ② | 继续滴加过量 | 产生黄色沉淀 | 目的:沉淀过量的 |
| ③ | 过滤洗涤,滴加少许指示剂于滤液中,用 | 结论: |
试剂级NaCl可用海盐(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、SO 等杂质)为原料制备。制备流程简图如下:
等杂质)为原料制备。制备流程简图如下:

(1)焙炒海盐的目的是_______ 。
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
(3)操作X为_______ 。
(4)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
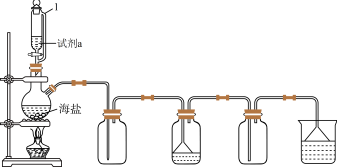
①试剂a为_______ 。相比分液漏斗,选用仪器1的优点是_______ 。
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是_______ 。

(1)焙炒海盐的目的是
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | BaCl2溶液 | SO |
| 步骤2 | ||
| 步骤3 |
(3)操作X为
(4)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①试剂a为
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


