解答题-原理综合题 适中0.65 引用6 组卷284
合成氨是人类科技发展史上的一项重大突破。
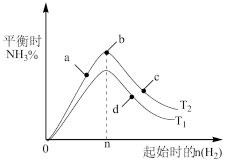
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 mol NH3(g),放出9.24 kJ的热量,写出该可逆反应的热化学方程式:_______ 。在图中画出合成氨反应过程中焓(H )的变化示意图______ 。

(2)将N2和H2通入体积为2 L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2 mol/L,这段时间内用N2的浓度变化表示的化学反应速率为_______ mol/(L·min)。
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是_______ (写出一条)。
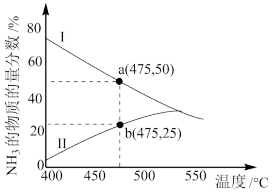
(4)图为某压强下N2和H2按物质的量之比1∶3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是_______ 。
A.图中a点,容器内n(N2)∶n(NH3)=1∶4
B.图中b点,υ正<υ逆
C.400~530 ℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 mol NH3(g),放出9.24 kJ的热量,写出该可逆反应的热化学方程式:

(2)将N2和H2通入体积为2 L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2 mol/L,这段时间内用N2的浓度变化表示的化学反应速率为
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是
(4)图为某压强下N2和H2按物质的量之比1∶3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是

A.图中a点,容器内n(N2)∶n(NH3)=1∶4
B.图中b点,υ正<υ逆
C.400~530 ℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
20-21高二上·北京西城·期末
类题推荐
合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)
_______ kJ·mol-1(用含a、b的代数式表示)
(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是_______ 。
②理论上,为了增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是_______ (写出1条)。
③将物质的量之比为1∶3的 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下 的转化率为
的转化率为_______ ,平衡常数
_______ (可用分数表示)。
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为_______ (填“正向”、“逆向”或“无法判断”)。
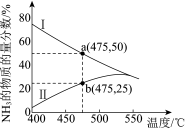
(3)图1是某压强下 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是_______ 。
a.图中a点,容器内
b.图中b点,
c.400~530℃,II中 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(4)电化学气敏传感器可用于检测环境中 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。

①反应消耗的 与
与 的物质的量之比为
的物质的量之比为_______ 。
②a极的电极反应式为_______ 。
已知:
(1)
(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是
②理论上,为了增大平衡时
③将物质的量之比为1∶3的
| 物质 | |||
| 平衡时物质的量 | 0.2 | 0.6 | 0.2 |
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为
| 物质 | |||
| 起始浓度(mol·L | 0.5 | 1.5 | 0.5 |

a.图中a点,容器内
b.图中b点,
c.400~530℃,II中
(4)电化学气敏传感器可用于检测环境中

①反应消耗的
②a极的电极反应式为
合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
(1)已知:2H2(g)+O2(g)=2H2O(g) ΔH1=-xkJ·mol-1
4NH3(g)+3O2(g)=2N2+6H2O(g) ΔH2=-ykJ·mol-1
N2(g)+3H2(g) 2NH3(g) ΔH3
2NH3(g) ΔH3
ΔH3 =_____ kJ·mol-1(用含x、y的代数式表示)。
(2)目前工业合成氨通常用以铁为主的催化剂在 400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是________ 。
②将物质的量之比为 1∶3 的N2 和H2 充入 2 L 的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2 的转化率为_______ ,平衡常数K = _______ (可用分数表示)。
③若按以下浓度投料,其它反应条件与②相同,起始时反应进行的方向为______ (填“正向”、“逆向”或“无法判断”)
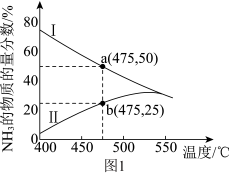
(3)下图是某压强下N2 和H2 按物质的量之比 1∶3 投料进行反应,反应混合物中NH3 的物质的量分数随温度的变化曲线,I 是平衡时的曲线,II 是不同温度下反应经过相同时间测得的曲线。
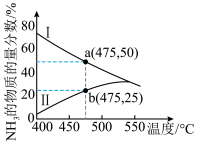
①图中a点,容器内n(N2):n(NH3)=______ 。
②图中b点,υ正____ υ逆(填“>”“<”或“=”)
③400~530℃,II 中NH3 的物质的量分数随温度升高而增大,原因是_______ 。
(1)已知:2H2(g)+O2(g)=2H2O(g) ΔH1=-xkJ·mol-1
4NH3(g)+3O2(g)=2N2+6H2O(g) ΔH2=-ykJ·mol-1
N2(g)+3H2(g)
ΔH3 =
(2)目前工业合成氨通常用以铁为主的催化剂在 400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是
②将物质的量之比为 1∶3 的N2 和H2 充入 2 L 的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
| 物质 | N2 | H2 | NH3 |
| 平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
③若按以下浓度投料,其它反应条件与②相同,起始时反应进行的方向为
| 物质 | N2 | H2 | NH3 |
| 初始投料/(mol/L) | 0.5 | 1.5 | 0.5 |
(3)下图是某压强下N2 和H2 按物质的量之比 1∶3 投料进行反应,反应混合物中NH3 的物质的量分数随温度的变化曲线,I 是平衡时的曲线,II 是不同温度下反应经过相同时间测得的曲线。

①图中a点,容器内n(N2):n(NH3)=
②图中b点,υ正
③400~530℃,II 中NH3 的物质的量分数随温度升高而增大,原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网