解答题-实验探究题 适中0.65 引用1 组卷296
高锰酸钾(KMnO4)又名灰锰氧,在实验室、化工生产、医疗等领域有广泛的应用。某实验小组利用MnO2为原料,与KClO3和KOH共熔制得锰酸钾,再利用歧化法制备高锰酸钾。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5 g KClO3和5.2 g KOH倒入铁坩埚中,加热熔融后将3 g MnO2分多次加入并搅拌至干涸,继续加热5 min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60 mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0 mol/L醋酸调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
(1)实验室常用高锰酸钾制O2,应选择下列哪套装置___
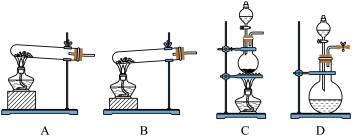
(2)①步骤Ⅰ中,墨绿色熔融物为___ (化学式)。
②反应1的化学方程式为___ 。
③铁坩埚不能换成瓷坩埚,原因是___ 。
(3)步骤Ⅱ中控制反应温度的方法是___ 。
(4)本实验采用6.0 mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如下表:
由表中数据得到结论____ 。
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2 mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是___ 。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5 g KClO3和5.2 g KOH倒入铁坩埚中,加热熔融后将3 g MnO2分多次加入并搅拌至干涸,继续加热5 min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60 mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0 mol/L醋酸调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
(1)实验室常用高锰酸钾制O2,应选择下列哪套装置

(2)①步骤Ⅰ中,墨绿色熔融物为
②反应1的化学方程式为
③铁坩埚不能换成瓷坩埚,原因是
(3)步骤Ⅱ中控制反应温度的方法是
(4)本实验采用6.0 mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如下表:
| 实验编号 | pH值 | 产量/g | 平均产率/% |
| 1 | 11.04 | 2.06 | 56.5 |
| 2 | 10.50 | 2.24 | 61.7 |
| 3 | 10.00 | 2.33 | 64.2 |
| 4 | 9.50 | 2.13 | 58.6 |
| 5 | 9.04 | 1.86 | 51.3 |
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2 mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是
21-22高三上·广东汕头·期末
类题推荐
高锰酸钾具有强氧化性,广泛用于化工、医药、采矿、金属冶炼及环境保护领域等。KMnO4的制备是以二氧化锰(MnO2)为原料,在强碱性介质中被氧化生成墨绿色的锰酸钾(K2MnO4);然后在一定pH下K2MnO4歧化生成紫色KMnO4。回答下列问题
(1)K2MnO4的制备
(2)KMnO4的制备
趁热向K2MnO4溶液中加入1 mol/L H3PO4溶液,直至K2MnO4全部歧化,判断全部歧化的方法是用玻璃棒蘸取溶液于滤纸上,现象为_________________________ 。然后趁热过滤,将滤液倒入蒸发皿中加热到液面出现晶膜,充分冷却后过滤,在80℃烘箱中干燥3h,不选用更高温度的原因是_____________________________ 。
(3)产品分析
i.不同pH下产品中KMnO4含量
从表格中数据分析,在歧化时选择溶液的最佳pH是________________ 。
ii.利用H2C2O4标准溶液测定KMnO4的纯度。测定步骤如下:
①溶液配制:称取1.000g的KMnO4固体样品,放入_____________ 中溶解,然后冷至室温后全部转移到100mL容量瓶中,加蒸馏水至刻度线。
②滴定:移取25 mLKMnO4溶液于锥形瓶中,加少量硫酸酸化,用0.1400mol/L的H2C2O4标准溶液滴定,发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10C02+8H2O,当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为23.90mL,则样品纯度为_______________ %(保留1位小数)。
(1)K2MnO4的制备
实验步骤 | 现象或解释 |
| ①称取2.5 gKClO3固体和5.2gKOH固体置于铁坩埚中,加热熔融 | 不用瓷坩埚的原因是 |
| ②分多次加入3gMnO2固体 | 不一次加入的原因是 |
趁热向K2MnO4溶液中加入1 mol/L H3PO4溶液,直至K2MnO4全部歧化,判断全部歧化的方法是用玻璃棒蘸取溶液于滤纸上,现象为
(3)产品分析
i.不同pH下产品中KMnO4含量
加入H3PO4体积/mL | 溶液的pH | 产品质量 | KMnO4质量 | KMnO4质量分数 |
10.50 | 12.48 | 2.35 | 2.05 | 87.23 |
12.50 | 11.45 | 2.45 | 2.18 | 88.98 |
14.50 | 10.89 | 2.18 | 1.87 | 85.78 |
16.50 | 10.32 | 2.28 | 1.75 | 76.75 |
18.50 | 9.44 | 2.09 | 1.48 | 70.81 |
ii.利用H2C2O4标准溶液测定KMnO4的纯度。测定步骤如下:
①溶液配制:称取1.000g的KMnO4固体样品,放入
②滴定:移取25 mLKMnO4溶液于锥形瓶中,加少量硫酸酸化,用0.1400mol/L的H2C2O4标准溶液滴定,发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10C02+8H2O,当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为23.90mL,则样品纯度为
高锰酸钾具有强氧化性,广泛应用于化工、医药、金属冶炼等领域。实验室可通过固体碱溶氧化法制备高锰酸钾。回答下列问题:
(1)称取2.45g (
( )和5.04g
)和5.04g (
( ),置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,除图中的部分仪器外,还需要
),置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,除图中的部分仪器外,还需要___________ (填仪器名称),不使用瓷坩埚的原因是___________ 。

(2)将3.48g (
( )分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色
)分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色 。该步反应的化学方程式为
。该步反应的化学方程式为___________ ,分多次加入 的原因是
的原因是___________ 。
(3)待铁坩埚冷却后,将其置于蒸馏水中共煮至固体全部溶解。趁热向浸取液中通入 ,使
,使 歧化为
歧化为 与
与 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。静置片刻,抽滤。该步骤若用 代替
代替 ,可能的后果是
,可能的后果是___________ 。
(4)水浴加热滤液至出现 晶膜,冷却后抽滤、干燥晶体。在该实验中采用水浴加热的主要优点是
晶膜,冷却后抽滤、干燥晶体。在该实验中采用水浴加热的主要优点是___________ 。下表是部分化合物溶解度随温度变化的数据,步骤(3)中 不宜通入过多,目的是
不宜通入过多,目的是___________ ,产品经纯化后称重,质量为3.60g。本实验中 的产率为
的产率为___________ %。
(1)称取2.45g

(2)将3.48g
(3)待铁坩埚冷却后,将其置于蒸馏水中共煮至固体全部溶解。趁热向浸取液中通入
(4)水浴加热滤液至出现
| 温度/℃ | 20 | 30 | 40 | 50 |
| 110 | 114 | 117 | 121 | |
| 33.7 | 39.9 | 47.5 | 65.6 | |
| 6.4 | 9.0 | 12.6 | 16.9 |
高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和工农业生产及医疗上有广泛应用。某实验小组用软锰矿(主要含MnO2)制备高锰酸钾晶体,并测定其纯度。一些化合物的溶解度S/g,(100g H2O)-1:
主要实验步骤如下:
I.高锰酸钾晶体的制备
步骤一:锰酸钾的制备。称取2.45g KClO3固体和5.22g KOH固体混合,小火加热,边加热边搅拌,待混合物熔融后再加入3.00g MnO2分多次小心加入,用铁棒不断搅拌,充分反应后得到墨绿色固体K2MnO4。
步骤二:锰酸钾的歧化。待步骤一所得固体冷却至室温后,将固体捣碎,放入盛有热水的烧杯中充分溶解直到熔融物全部溶解。趁热向溶液中通入CO2,溶液由绿色逐渐变为紫色同时产生黑色沉淀MnO2,至锰酸钾全部歧化为止,静置,抽滤。
步骤三:高锰酸钾的浓缩结晶。将滤液转移至蒸发皿中,经_______,抽滤至干。将晶体转移至已知质量的表面皿中,放入烘箱中80℃干燥半小时左右,冷却,称量,产品质量为2.73g。
根据以上实验操作回答下列问题:
(1)步骤一:MnO2是该反应的_______ (填“氧化剂”或“还原剂”);加热熔融时应选用的仪器是_______ (填写序号)。
a.瓷坩埚 b.刚玉坩埚 c.铁坩埚 d.石英坩埚
熔融时加入MnO2后发生反应的化学方程式为_______ 。
(2)步骤二:向绿色溶液通入CO2,除以上产物外还生成一种碳酸盐,则发生反应的离子方程式为_______ 。锰酸钾歧化时不能用盐酸代替CO2,原因是_______ 。
(3)步骤三空白处的操作为_______ 。
(4)该实验小组制备高锰酸钾粗品的产率是_______ %(保留1位小数)。
II.高锰酸钾纯度测定
(5)利用氧化还原滴定法进行高锰酸钾纯度分析。现称取制得的高锰酸钾产品1.6000g,配成250mL溶液,用酸式滴定管量取25.00mL待测液,再加入少量硫酸酸化。用0.1000mol·L-1 的草酸钾标准溶液进行滴定,滴定终点时消耗标准溶液的体积为18.00mL(不考虑杂质的反应),达到滴定终点的现象是_______ ,高锰酸钾产品的纯度为_______ (保留3位有效数字,假设杂质不反应)。(已知滴定过程中涉及到的反应:Na2C2O4+H2SO4→H2C2O4+Na2SO4;H2C2O4+MnO +H+→Mn2++CO2↑+H2O)。
+H+→Mn2++CO2↑+H2O)。
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
| K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
| KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
I.高锰酸钾晶体的制备
步骤一:锰酸钾的制备。称取2.45g KClO3固体和5.22g KOH固体混合,小火加热,边加热边搅拌,待混合物熔融后再加入3.00g MnO2分多次小心加入,用铁棒不断搅拌,充分反应后得到墨绿色固体K2MnO4。
步骤二:锰酸钾的歧化。待步骤一所得固体冷却至室温后,将固体捣碎,放入盛有热水的烧杯中充分溶解直到熔融物全部溶解。趁热向溶液中通入CO2,溶液由绿色逐渐变为紫色同时产生黑色沉淀MnO2,至锰酸钾全部歧化为止,静置,抽滤。
步骤三:高锰酸钾的浓缩结晶。将滤液转移至蒸发皿中,经_______,抽滤至干。将晶体转移至已知质量的表面皿中,放入烘箱中80℃干燥半小时左右,冷却,称量,产品质量为2.73g。
根据以上实验操作回答下列问题:
(1)步骤一:MnO2是该反应的
a.瓷坩埚 b.刚玉坩埚 c.铁坩埚 d.石英坩埚
熔融时加入MnO2后发生反应的化学方程式为
(2)步骤二:向绿色溶液通入CO2,除以上产物外还生成一种碳酸盐,则发生反应的离子方程式为
(3)步骤三空白处的操作为
(4)该实验小组制备高锰酸钾粗品的产率是
II.高锰酸钾纯度测定
(5)利用氧化还原滴定法进行高锰酸钾纯度分析。现称取制得的高锰酸钾产品1.6000g,配成250mL溶液,用酸式滴定管量取25.00mL待测液,再加入少量硫酸酸化。用0.1000mol·L-1 的草酸钾标准溶液进行滴定,滴定终点时消耗标准溶液的体积为18.00mL(不考虑杂质的反应),达到滴定终点的现象是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


