解答题-原理综合题 较难0.4 引用1 组卷252
尿素 是一种重要的氮肥.工业上常以液氨和
是一种重要的氮肥.工业上常以液氨和 为原料合成尿素,合成反应如下:
为原料合成尿素,合成反应如下:
反应ⅰ:
反应ⅱ:
(1)合成尿素总反应的热化学方程式为_______ 。
(2)为防止反应ⅰ中氨基甲酸铵 分解成
分解成 和
和 ,应采取的措施是
,应采取的措施是_______ (填标号)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
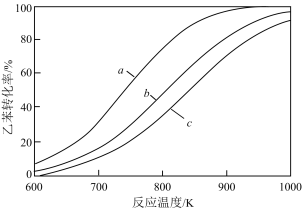
(3)Frejacques测定反应ⅱ中氨基甲酸铵[氨碳比 ]脱水速率,获得
]脱水速率,获得 转化率(
转化率( )与反应温度、反应时间的关系如图。
)与反应温度、反应时间的关系如图。
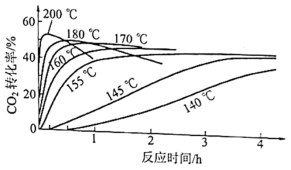
①当反应温度高于氨基甲酸铵熔点时,脱水速率明显加快.则氨基甲酸铵熔点位于_______ (填标号)。
A.140~145℃ B.145~155℃ C.155~160℃ D.160~170℃
②尿素会发生如下水解及缩合副反应:
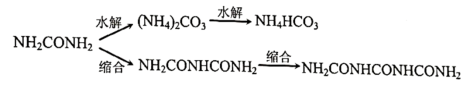
温度升高,副反应加剧.当氨碳比 、反应温度高于200℃时,
、反应温度高于200℃时, 转化率却不会随反应时间的延长而下降,其原因是
转化率却不会随反应时间的延长而下降,其原因是_______ 。
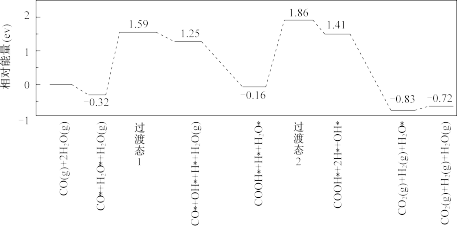
(4)我国科学家利用电催化偶联 和
和 制备尿素.结合实验与计算机模拟结果,研究了
制备尿素.结合实验与计算机模拟结果,研究了 合金表面碳氮偶联的反应历程,如图所示,其中吸附在
合金表面碳氮偶联的反应历程,如图所示,其中吸附在 合金表面上的物种用*标注。
合金表面上的物种用*标注。
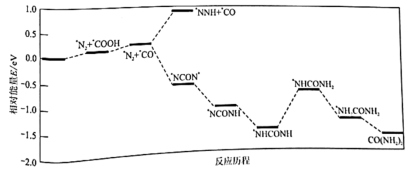
①已知尿素中碳元素为+4价.碳氮偶联过程中化合价发生变化的元素有_______ 。
②碳氮偶联过程,氮原子上结合第_______ 个H+是生成尿素的决速步骤。
③碳氮偶联形成中间体 ,大大抑制了副产物
,大大抑制了副产物_______ 的形成(填化学式)。
反应ⅰ:
反应ⅱ:
(1)合成尿素总反应的热化学方程式为
(2)为防止反应ⅰ中氨基甲酸铵
A.升高温度 B.降低温度 C.增大压强 D.减小压强
(3)Frejacques测定反应ⅱ中氨基甲酸铵[氨碳比

①当反应温度高于氨基甲酸铵熔点时,脱水速率明显加快.则氨基甲酸铵熔点位于
A.140~145℃ B.145~155℃ C.155~160℃ D.160~170℃
②尿素会发生如下水解及缩合副反应:

温度升高,副反应加剧.当氨碳比
(4)我国科学家利用电催化偶联

①已知尿素中碳元素为+4价.碳氮偶联过程中化合价发生变化的元素有
②碳氮偶联过程,氮原子上结合第
③碳氮偶联形成中间体
20-21高二上·福建厦门·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网