单选题 适中0.65 引用2 组卷51
某同学设计如图装置探究H2O2、SO2、I2的氧化性强弱。首先用N2排净装置内空气,然后通入SO2,甲中蓝色溶液褪色,乙中产生不溶于盐酸的白色沉淀;关闭弹簧夹,打开甲中分液漏斗活塞,逐滴滴加H2O2溶液,开始时颜色无明显变化,继续滴加H2O2溶液,混合液逐渐变成蓝色。下列说法错误的是
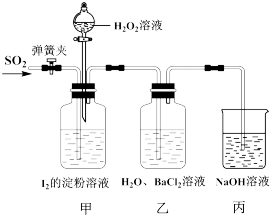

| A.甲中蓝色溶液褪色说明SO2将I2还原 |
| B.乙中反应的离子方程式是SO2+Ba2++H2O2=BaSO4↓+2H+ |
| C.实验中“开始时颜色无明显变化”的原因是SO2与H2O2反应 |
| D.由实验可知H2O2、SO2、I2氧化性由强到弱的顺序是I2>H2O2>SO2 |
20-21高一上·福建泉州·阶段练习
类题推荐
为探究 、
、 、
、 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验;查阅资料可知,
氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验;查阅资料可知, 易溶于
易溶于 )。
)。
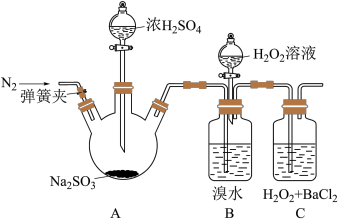
(1)A中发生反应(填“是”或“不是”)___________ 氧化还原反应。
(2)B中红棕色溴水褪色,此时发生反应的离子方程式___________ 。
(3)C中产生的白色沉淀是___________ 。
(4)甲同学通过C中产生白色沉淀,得出结论,氧化性: 。
。
①乙同学认为不能得出此结论,对实验进行了改进:打开弹簧夹,通入 ,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞;
,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞;
②丙同学进行了进一步的改进:在B和C之间增加盛放 的洗气瓶D,丙同学的目的是
的洗气瓶D,丙同学的目的是___________ 。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性 。
。
(5)iii中滴入少量 没有明显变化。提出假设:
没有明显变化。提出假设:
观点1: 的量少不能氧化
的量少不能氧化
观点2:B中有未反应
为验证观点2,应进行的实验操作及现象是:取少量颜色变化前的B中溶液于试管中___________ 。继续滴加 溶液,一段时间后,混合液逐渐变成红棕色,此时发生反应的离子方程式
溶液,一段时间后,混合液逐渐变成红棕色,此时发生反应的离子方程式___________ 。
(6)通过上述全部实验,得出结论: 、
、 、
、 氧化性由强到弱的顺序是
氧化性由强到弱的顺序是___________ 。

实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加 | 开始时颜色无明显变化;继续滴加 |
(2)B中红棕色溴水褪色,此时发生反应的离子方程式
(3)C中产生的白色沉淀是
(4)甲同学通过C中产生白色沉淀,得出结论,氧化性:
①乙同学认为不能得出此结论,对实验进行了改进:打开弹簧夹,通入
②丙同学进行了进一步的改进:在B和C之间增加盛放
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性
(5)iii中滴入少量
观点1:
观点2:B中有未反应
为验证观点2,应进行的实验操作及现象是:取少量颜色变化前的B中溶液于试管中
(6)通过上述全部实验,得出结论:
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
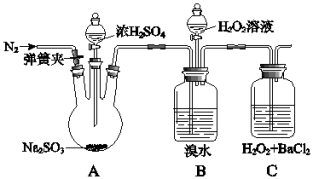
(1)A中发生反应的化学方程式是___________ 。
(2)B中棕色褪色的离子方程式是___________ 。
(3)①甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2.C中产生白色沉淀的离子反应方程式是___________ 。
②乙同学认为不能得出此结论,认为在滴加浓硫酸之前应打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹。
③丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是___________ 。
④将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是___________ 。

| 实验操作 | 实验现象 |
| i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中棕色褪色,C中有白色沉淀 |
| ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)B中棕色褪色的离子方程式是
(3)①甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2.C中产生白色沉淀的离子反应方程式是
②乙同学认为不能得出此结论,认为在滴加浓硫酸之前应打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹。
③丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是
④将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是
为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)

(1)B 中红棕色褪色的离子方程式是________________ 。
(2)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_________________ 。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是______________ 。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是__________________ 。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(3)iii 中滴入少量 H2O2没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_______________ 。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是____________ 。

| 实验操作 | 实验现象 |
| i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
| ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
| iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)B 中红棕色褪色的离子方程式是
(2)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(3)iii 中滴入少量 H2O2没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


