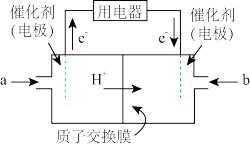
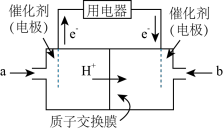
解答题-原理综合题 较难0.4 引用1 组卷388
CO2既是温室气体,也是重要的化工原料,CO2的捕捉和利用是我国能源领域的一个重要战略方向。
(1)已知:①4H2(g)+2O2(g) 4H2O(g) ΔH1=-1067.2 kJ/mol;
4H2O(g) ΔH1=-1067.2 kJ/mol;
②CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH2=-802.0 kJ/mol。
CO2(g)+2H2O(g) ΔH2=-802.0 kJ/mol。
则CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH =___________ kJ/mol。
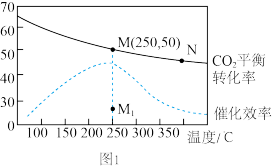
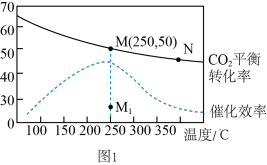
(2)在体积为1 L的密闭恒容容器中,充入4 mol H2和1 mol CO2,发生反应:CO2(g)+4H2(g) CH4(g)+2H2O(g),测得温度对CO2的平衡转化率(%)和催化剂催化效率的影响如图所示。
CH4(g)+2H2O(g),测得温度对CO2的平衡转化率(%)和催化剂催化效率的影响如图所示。
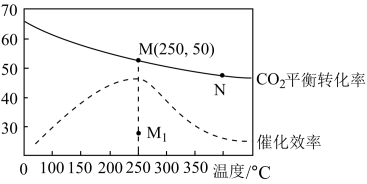
①欲提高CO2的平衡转化率,可采取的措施有___________ (填序号)。
A.通入惰性气体 B.升高温度 C.增加H2浓度 D.增加CO2浓度 E.使H2O液化分离
②下列说法正确的是___________ (填序号)。
A.平衡常数大小:KN<KM
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.当压强或混合气体的密度保持不变时均可证明化学反应已达到平衡状态
D.其他条件不变,加入催化剂可以降低该反应活化能,ΔH不变
③已知M点总压为2 MPa,该反应在此温度下的平衡常数Kp=___________ MPa-2(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数)
(3)工业上用NaOH溶液作CO2捕捉剂可以降低碳排放,若标况下将4.48 L CO2通入200 mL 1.5 mol/L NaOH溶液中,写出此反应的离子方程式:___________ ,所得溶液离子浓度由大到小的顺序为 ___________ ,若常温下某次捕捉后得到pH=10的溶液,则溶液中c(CO )∶c (HCO
)∶c (HCO )=
)=___________ 。[已知常温下K1(H2CO3)=4.4×10-7;K2(H2CO3)=5×10-11]
(1)已知:①4H2(g)+2O2(g)
②CH4(g)+2O2(g)
则CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH =
(2)在体积为1 L的密闭恒容容器中,充入4 mol H2和1 mol CO2,发生反应:CO2(g)+4H2(g)

①欲提高CO2的平衡转化率,可采取的措施有
A.通入惰性气体 B.升高温度 C.增加H2浓度 D.增加CO2浓度 E.使H2O液化分离
②下列说法正确的是
A.平衡常数大小:KN<KM
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.当压强或混合气体的密度保持不变时均可证明化学反应已达到平衡状态
D.其他条件不变,加入催化剂可以降低该反应活化能,ΔH不变
③已知M点总压为2 MPa,该反应在此温度下的平衡常数Kp=
(3)工业上用NaOH溶液作CO2捕捉剂可以降低碳排放,若标况下将4.48 L CO2通入200 mL 1.5 mol/L NaOH溶液中,写出此反应的离子方程式:
21-22高三上·黑龙江哈尔滨·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网