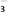解答题-工业流程题 适中0.65 引用1 组卷354
连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性,在空气中易被氧化,受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
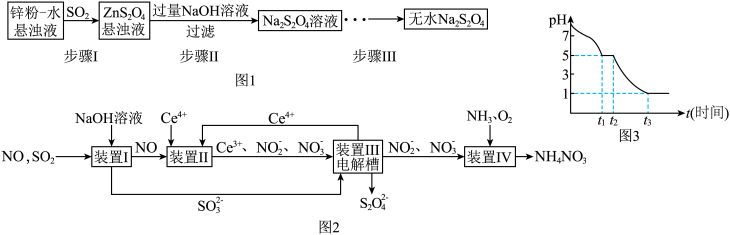
(1)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
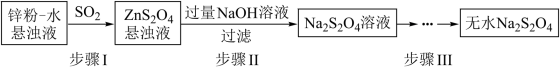
①步骤I中SO2表现了___________ (填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是___________ (填序号)。
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4 悬浊液中c(Zn2+)=0.05mol•L-1,则应加氢氧化钠溶液调至pH≥___________ ,才能使Zn(OH)2沉淀完全。(已知离子浓度≤1.0×10-5mol•L-1,即沉淀完全;Ksp[Zn(OH)2]=4.0×10-17;lg2=0.3)
③步骤III中得到的Na2S2O4要用乙醇洗涤,其优点是___________ 。请写出具体的洗涤操作过程___________ 。
(2)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)和烧碱溶于乙醇水溶液中,再通入SO2发生反应,有CO2气体放出,析出Na2S2O4固体,总反应的化学方程式为___________ 。
(3)Na2S2O4固体在隔绝空气的条件下加热至75℃时完全分解,生成Na2SO3、Na2S2O3、SO2,检验产物中是否含有Na2SO4的实验方法是___________ 。
(1)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:

①步骤I中SO2表现了
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4 悬浊液中c(Zn2+)=0.05mol•L-1,则应加氢氧化钠溶液调至pH≥
③步骤III中得到的Na2S2O4要用乙醇洗涤,其优点是
(2)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)和烧碱溶于乙醇水溶液中,再通入SO2发生反应,有CO2气体放出,析出Na2S2O4固体,总反应的化学方程式为
(3)Na2S2O4固体在隔绝空气的条件下加热至75℃时完全分解,生成Na2SO3、Na2S2O3、SO2,检验产物中是否含有Na2SO4的实验方法是
21-22高三上·黑龙江哈尔滨·期末
类题推荐
保险粉又称连二亚硫酸钠(Na2S2O4),可用于纺织工业的漂白剂、脱色剂,脱氯剂。Na2S2O4是白色粉末,无味,易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。
Ⅰ.甲酸钠(HCOONa)法制备过程如下:
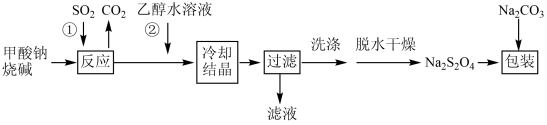
(1)连二亚硫酸钠中硫元素的化合价为______________ 。
(2)实验室用Na2SO3 固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。
(3)步骤①中制备连二亚硫酸钠的化学方程式可表示为____________________________ 。
(4)上述步骤②中,加入适量乙醇水溶液的作用是______________ 。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_________________________ 。
(6)①现将0.05mol/L Na2S2O4溶液在空气中放置,其溶液的pH 与时间(t)的关系如图所示。
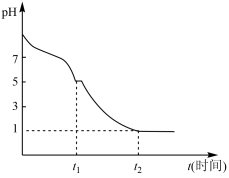
t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为_______________ 。
②t1~t2段发生化学反应的离子方程式为______________________________ 。
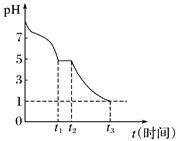
Ⅱ.电解法制备:工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。过程如图所示
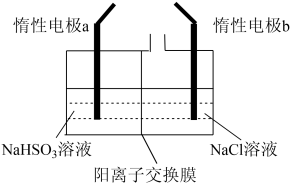
(7)①产品在_________________ (填“阳极”、“阴极”)得到。
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是__________________________________ 。
Ⅰ.甲酸钠(HCOONa)法制备过程如下:

(1)连二亚硫酸钠中硫元素的化合价为
(2)实验室用Na2SO3 固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。
| A.浓盐酸 | B.浓硝酸 |
| C.质量分数为70%的硫酸 | D.质量分数为10%的硫酸 |
(4)上述步骤②中,加入适量乙醇水溶液的作用是
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是
(6)①现将0.05mol/L Na2S2O4溶液在空气中放置,其溶液的pH 与时间(t)的关系如图所示。

t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为
②t1~t2段发生化学反应的离子方程式为
Ⅱ.电解法制备:工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。过程如图所示

(7)①产品在
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网