解答题-实验探究题 适中0.65 引用7 组卷301
Na2S2O3俗称大苏打(海波),是重要的化工原料,无色易溶于水,不溶于乙醇,在中性或碱性环境中稳定,在40~45 ℃熔化,48 ℃分解。实验室用Na2SO3和过量硫粉(不溶于水,可溶于乙醇)在水溶液中加热反应制取Na2S2O3·5H2O晶体【Na2SO3(aq)+S(s)  Na2S2O3(aq)】的步骤如下:
Na2S2O3(aq)】的步骤如下:
① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
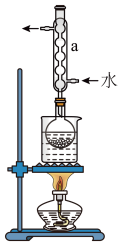
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)
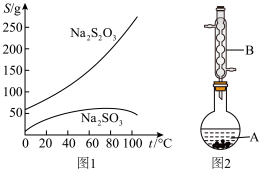
(1) 图2中,仪器B的名称是___________ 。
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是___________ 。
(3) 实验步骤③中,趁热过滤的原因是___________ 。
(4) 实验步骤④中,应采取的相关实验操作为___________ 。
(5) 实验步骤⑤中,采用低温干燥的目的是___________ 。
(6) 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___________ 。
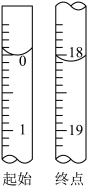
(7) 准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O +I2=S4O
+I2=S4O +2I-。滴定至终点时,溶液颜色的变化是
+2I-。滴定至终点时,溶液颜色的变化是___________ 。消耗碘的标准溶液体积为36.00 mL,产品的纯度为___________ 。
① 称取一定量的Na2SO3于烧杯中,溶于水。
② ②另取过量的硫粉,用少许乙醇润湿后,加到上述溶液中。
③ 如图2所示(部分装置略去),水浴加热,微沸,反应后趁热过滤。
④ 滤液在经过相关实验操作后析出Na2S2O3·5H2O晶体。
⑤ 进行减压过滤并低温干燥。
(图1是有关物质的溶解度曲线)

(1) 图2中,仪器B的名称是
(2) 实验步骤②中,加入的硫粉用乙醇润湿的目的是
(3) 实验步骤③中,趁热过滤的原因是
(4) 实验步骤④中,应采取的相关实验操作为
(5) 实验步骤⑤中,采用低温干燥的目的是
(6) 产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是
(7) 准确称取2.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。反应原理为2S2O
20-21高三上·江苏南京·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网