解答题-工业流程题 较难0.4 引用2 组卷441
氯化亚铜是一种重要的化工原料,一种利用低品位铜矿(主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等)为原料制取CuCl的工艺流程如图:
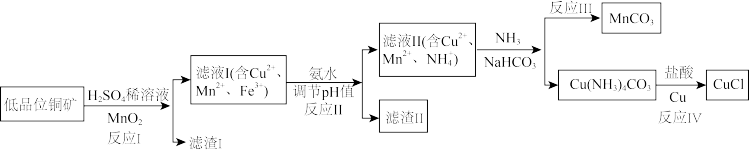
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________ ;
(2)滤渣Ⅰ的成分除S和MnO2外还含有___________ , 反应Ⅰ中MnO2的作用为___________
(3)已知生成氢氧化物的pH如表,则反应Ⅱ“中和”时,用氨水调pH的范围是___________ 。
(4)检验滤液Ⅱ中是否含有Fe3+所需要的试剂是___________
(5)①反应Ⅲ中生成难溶MnCO3的离子方程式___________ :②反应Ⅳ所对应的化学方程式:___________
(6)CuCl的定量分析
步骤1.取样品0.7500 g和30.0 mL1.0 mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000 mol·L-1Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如表
已知:CuCl+FeCl3=CuCl2+FeCl2;Fe2++Ce4+=Fe3++Ce3+。
①数据处理:计算得CuCl的纯度为___________ %
②误差分析:下列操作会使测定结果偏高的是:___________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000 mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.振荡锥形瓶时部分液体溅出

(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是
(2)滤渣Ⅰ的成分除S和MnO2外还含有
(3)已知生成氢氧化物的pH如表,则反应Ⅱ“中和”时,用氨水调pH的范围是
| 物质 | Cu(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 8.3 | 1.2 |
| 完全沉淀pH | 6.7 | 9.8 | 3.2 |
(4)检验滤液Ⅱ中是否含有Fe3+所需要的试剂是
(5)①反应Ⅲ中生成难溶MnCO3的离子方程式
(6)CuCl的定量分析
步骤1.取样品0.7500 g和30.0 mL1.0 mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000 mol·L-1Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如表
| 序号 | 1 | 2 | 3 |
| 起始读数/mL | 0.95 | 0.70 | 1.00 |
| 终点读数/mL | 20.95 | 24.95 | 21.00 |
已知:CuCl+FeCl3=CuCl2+FeCl2;Fe2++Ce4+=Fe3++Ce3+。
①数据处理:计算得CuCl的纯度为
②误差分析:下列操作会使测定结果偏高的是:
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000 mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.振荡锥形瓶时部分液体溅出
19-20高三上·河北石家庄·阶段练习
类题推荐
实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____ (任写一种)。
(2)滤渣1为Fe(OH)3,则调节pH的范围为____ 。
(3)“一系列操作”主要包括加入足量盐酸,然后经过蒸发浓缩、冷却结晶、过滤、洗涤,即得到氯化镁晶体。加入足量 盐酸的作用为①溶解滤渣2,②____ 。
(4)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加50 mL蒸馏水使其完全溶解,在不断振荡下,调节pH并加入合适的指示剂,用0.5000 mol/L的EDTA(在方程式中用Y4−表示)标准溶液进行滴定,其反应原理为Mg2++Y4− = MgY2−,滴定达到终点时消耗EDTA标准溶液的体积为19.00 mL。
①计算产品中MgCl2·6H2O的质量分数。____ (写出计算过程,结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是____ (填字母)。
a.滴定终点时仰视读数
b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出
d.滴定前滴定管尖嘴处有气泡,滴定后气泡消失

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有
(2)滤渣1为Fe(OH)3,则调节pH的范围为
(3)“一系列操作”主要包括加入足量盐酸,然后经过蒸发浓缩、冷却结晶、过滤、洗涤,即得到氯化镁晶体。加入
(4)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加50 mL蒸馏水使其完全溶解,在不断振荡下,调节pH并加入合适的指示剂,用0.5000 mol/L的EDTA(在方程式中用Y4−表示)标准溶液进行滴定,其反应原理为Mg2++Y4− = MgY2−,滴定达到终点时消耗EDTA标准溶液的体积为19.00 mL。
①计算产品中MgCl2·6H2O的质量分数。
②下列滴定操作会导致测量结果偏高的是
a.滴定终点时仰视读数
b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出
d.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
MnSO4是一种重要的化工产品。
Ⅰ.实验室用 SO2还原MnO2制备MnSO4,某同学设计下列装置制备硫酸锰。
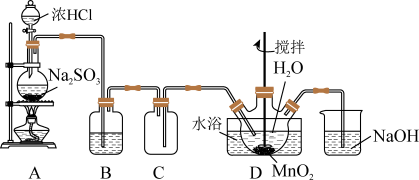
(1)A中盛放浓盐酸的仪器名称为_______ ;装置B中试剂为 _______ ; 装置C的作用为_______ 。
Ⅱ.工业上以菱锰矿(主要成分为MnCO3,还含有Fe3O4、 FeO、CoO等)为原料制备MnSO4的工艺流程如下图。
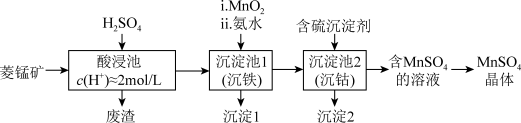
资料:金属离子沉淀的pH
(2)酸浸后所得溶液的金属阳离子包括Mn2+、Co2+、_______ 。
(3)沉淀池1中,写出加入MnO2的作用:_______ 。
(4)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
(5)“酸浸池”所得的废渣中 还含有锰元素,其含量测定方法如下。
Ⅰ:称取ag废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
Ⅱ :取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
Ⅲ:加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为c mL, 重新转化成Mn2+。
重新转化成Mn2+。
①废渣中锰元素物质的量为_______ 。
②下列操作会导致测定结果偏高的_______ (填字母)。
a.未煮沸溶液就开始滴定
b.滴定开始时仰视读数
c.滴定管滴定前有气泡,滴定后气泡消失
Ⅰ.实验室用 SO2还原MnO2制备MnSO4,某同学设计下列装置制备硫酸锰。

(1)A中盛放浓盐酸的仪器名称为
Ⅱ.工业上以菱锰矿(主要成分为MnCO3,还含有Fe3O4、 FeO、CoO等)为原料制备MnSO4的工艺流程如下图。

资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
(3)沉淀池1中,写出加入MnO2的作用:
(4)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(5)“酸浸池”所得的废渣中 还含有锰元素,其含量测定方法如下。
Ⅰ:称取ag废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
Ⅱ :取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
Ⅲ:加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为c mL,
①废渣中锰元素物质的量为
②下列操作会导致测定结果偏高的
a.未煮沸溶液就开始滴定
b.滴定开始时仰视读数
c.滴定管滴定前有气泡,滴定后气泡消失
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网