解答题-实验探究题 适中0.65 引用1 组卷306
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效广谱的灭菌消毒剂。某化学小组针对氯气及其化合物展开以下实验。
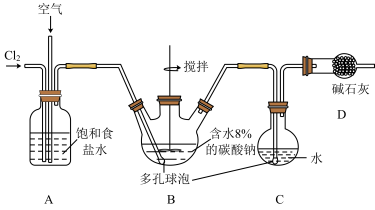
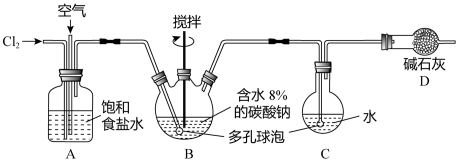
Ⅰ.氯碱工业是工业上制备氯气的主要方法,该实验小组采用如下图所示的装置来模拟工业制取氯气。回答下列问题:
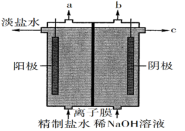
(1)氯气的逸出口是___________ (填“a”或“b”),为了获得比较纯净的NaOH溶液,电解过程中最好选用___________ 离子交换膜(填“阴”或“阳”),电解过程总反应的离子方程式为___________
(2)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___________
Ⅱ.“84”消毒液是生活中常见的高效杀毒剂,其主要成分为NaClO。某校学生为了测定蓝月亮牌“84”消毒液中NaClO的浓度,进行了如下实验:
①取10.00mL“84”消毒液于烧杯中,加水稀释并恢复至室温后,转移到1000mL容量瓶中定容后备用。
②取20.00mL稀释后的溶液于锥形瓶中,滴加稀H2SO4和过量的KI溶液,NaClO将KI氧化成I2。
③用淀粉做指示剂,生成的I2用0.0800 mol/L Na2S2O3标准溶液滴定至终点,发生的反应为:I2 + 2S2O =2I-+S4O
=2I-+S4O 。
。
④重复滴定3次。
所得数据如下:
回答下列问题:
(3)步骤①定容时还需要的玻璃仪器是___________ ,Na2S2O3标准溶液应该装在___________ 滴定管中
(4)步骤②发生反应的离子方程式为___________
(5)步骤③滴定终点的现象为___________
(6)若滴定前标准液滴定管尖嘴管处有气泡,滴定结束后气泡消失,则会使测定结果___________ (填“偏高”或“偏低”或“不变”)。经过计算测出蓝月亮牌“84”消毒液中NaClO的物质的量浓度为___________ mol/L(精确到小数点后1位)
Ⅰ.氯碱工业是工业上制备氯气的主要方法,该实验小组采用如下图所示的装置来模拟工业制取氯气。回答下列问题:

(1)氯气的逸出口是
(2)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
Ⅱ.“84”消毒液是生活中常见的高效杀毒剂,其主要成分为NaClO。某校学生为了测定蓝月亮牌“84”消毒液中NaClO的浓度,进行了如下实验:
①取10.00mL“84”消毒液于烧杯中,加水稀释并恢复至室温后,转移到1000mL容量瓶中定容后备用。
②取20.00mL稀释后的溶液于锥形瓶中,滴加稀H2SO4和过量的KI溶液,NaClO将KI氧化成I2。
③用淀粉做指示剂,生成的I2用0.0800 mol/L Na2S2O3标准溶液滴定至终点,发生的反应为:I2 + 2S2O
④重复滴定3次。
所得数据如下:
| 待测液体积(mL) | 标准液滴定前读数(mL) | 标准液滴定后读数(mL) | 消耗标准液体积(mL) | |
| 1 | 20.00 | 0.02 | 20.02 | |
| 2 | 20.00 | 0.24 | 20.26 | |
| 3 | 20.00 | 0.12 | 20.10 | |
| 4 | 20.00 | 0.20 | 21.20 |
(3)步骤①定容时还需要的玻璃仪器是
(4)步骤②发生反应的离子方程式为
(5)步骤③滴定终点的现象为
(6)若滴定前标准液滴定管尖嘴管处有气泡,滴定结束后气泡消失,则会使测定结果
20-21高二上·黑龙江齐齐哈尔·期末
类题推荐
I.乙酸、碳酸、次氯酸、亚磷酸(H3PO3)在生产、生活及医药方面有广泛用途。已知25℃时,部分物质的电离常数如表所示。
(1)根据表中数据,将pH=3的下列三种酸溶液分别稀释100倍,pH变化最小的是______ 。
a.CH3COOH b.H2CO3 c.HClO
(2)常温下相同浓度的下列溶液:①CH3COONH4②CH3COONa③CH3COOH,其中c(CH3COO-)由大到小的顺序是______ (填标号)。
(3)常温下,pH=10的CH3COONa溶液中,由水电离出来的c(OH-)=______ mol/L;请设计实验,比较常温下0.1mol/LCH3COONa溶液的水解程度和0.1mol/LCH3COOH溶液的电离程度大小:_____ (简述实验步骤和结论)。
Ⅱ.化学工业为疫情防控提供了强有力的物质支撑。许多含氯化合物既是重要化工原料,又是高效、广谱灭菌消毒剂。
(4)NaClO2是一种高效漂白剂。在NaClO2溶液中存在ClO2、HClO2、ClO 、Cl-等微粒。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-未画出)。
、Cl-等微粒。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-未画出)。
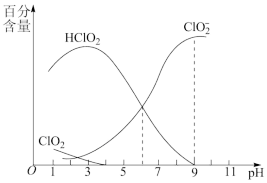
①25℃时,Ka(HClO2)=______ mol•L-1。
②25℃时,浓度均为0.1mol•L-1的HClO2溶液和NaClO2溶液等体积混合后,c(HClO2)______ c(ClO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
(5)可利用如图装置测定气体ClO2的质量,过程如图:
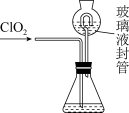
步骤1:在锥形瓶中加入足量KI(s),用100mL水溶解后,再加3mL稀硫酸;
步骤2:向玻璃液封管中加水;
步骤3:将生成的ClO2气体通入锥形瓶中被充分吸收(已知:ClO2+I-+H+→I2+Cl-+H2O,未配平);
步骤4:将玻璃液封管中的水封液全部倒入锥形瓶中,加入几滴淀粉溶液,用cmol•L-1Na2S2O3标准溶液滴定(I2+2S2O =2I-+S4O
=2I-+S4O ),消耗Na2S2O3溶液VmL。
),消耗Na2S2O3溶液VmL。
①滴定至终点的颜色变化是______ 。
②测得ClO2的质量m(ClO2)=______ (用含c,V的代数式表示)。
③下列操作将导致测定结果偏高的是______ (填标号)。
A.未将玻璃液封管中的水封液倒入锥形瓶中
B.滴定管未用标准液润洗
C.滴定前平视读数,滴定后俯视读数
D.滴定后,滴定管尖嘴处悬挂一滴液体
| 弱酸 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.8×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
a.CH3COOH b.H2CO3 c.HClO
(2)常温下相同浓度的下列溶液:①CH3COONH4②CH3COONa③CH3COOH,其中c(CH3COO-)由大到小的顺序是
(3)常温下,pH=10的CH3COONa溶液中,由水电离出来的c(OH-)=
Ⅱ.化学工业为疫情防控提供了强有力的物质支撑。许多含氯化合物既是重要化工原料,又是高效、广谱灭菌消毒剂。
(4)NaClO2是一种高效漂白剂。在NaClO2溶液中存在ClO2、HClO2、ClO

①25℃时,Ka(HClO2)=
②25℃时,浓度均为0.1mol•L-1的HClO2溶液和NaClO2溶液等体积混合后,c(HClO2)
(5)可利用如图装置测定气体ClO2的质量,过程如图:

步骤1:在锥形瓶中加入足量KI(s),用100mL水溶解后,再加3mL稀硫酸;
步骤2:向玻璃液封管中加水;
步骤3:将生成的ClO2气体通入锥形瓶中被充分吸收(已知:ClO2+I-+H+→I2+Cl-+H2O,未配平);
步骤4:将玻璃液封管中的水封液全部倒入锥形瓶中,加入几滴淀粉溶液,用cmol•L-1Na2S2O3标准溶液滴定(I2+2S2O
①滴定至终点的颜色变化是
②测得ClO2的质量m(ClO2)=
③下列操作将导致测定结果偏高的是
A.未将玻璃液封管中的水封液倒入锥形瓶中
B.滴定管未用标准液润洗
C.滴定前平视读数,滴定后俯视读数
D.滴定后,滴定管尖嘴处悬挂一滴液体
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网