解答题-工业流程题 适中0.65 引用1 组卷140
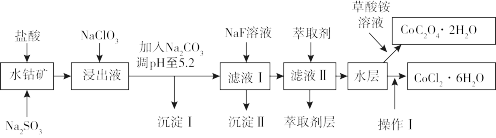
Ⅰ.利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
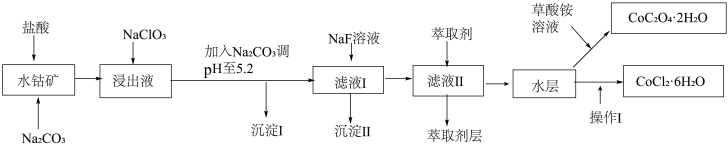
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3目的是______ 。
(2)NaClO3在浸出液中发生反应的离子方程式为______ 。
(3)加入Na2CO3调pH至5.2,目的是______ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为______ 。
Ⅱ.科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-)
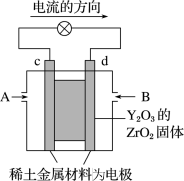
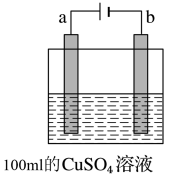
甲 乙
(1)d电极上的电极反应式为______ ;
(2)图乙是用惰性电极电解100mL 0.5mol•L-1 CuSO4溶液,a电极上的电极反应式为______ ;若a电极产生56mL(标准状况)气体,则所得溶液的pH=______ (不考虑溶液体积变化及离子的水解),若要使电解质溶液恢复到电解前的状态,可加入______ (选填字母序号)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是
(2)NaClO3在浸出液中发生反应的离子方程式为
(3)加入Na2CO3调pH至5.2,目的是
Ⅱ.科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-)


甲 乙
(1)d电极上的电极反应式为
(2)图乙是用惰性电极电解100mL 0.5mol•L-1 CuSO4溶液,a电极上的电极反应式为
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
20-21高二上·山西太原·阶段练习
类题推荐
利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,如图为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
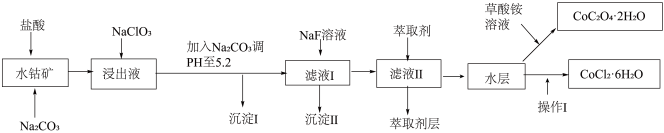
已知:①过滤后的浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中Co2O3发生反应的离子反应方程式为_______ 。
(2)NaClO3在浸出液中的作用_______ 。
(3)加入Na2CO3调pH至5.2,目的是_______ ;萃取剂层含锰元素,则沉淀II的主要成分为MgF2和______ 。

已知:①过滤后的浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3在浸出液中的作用
(3)加入Na2CO3调pH至5.2,目的是
利用水钴矿(主要成分为Co2O3,含少量Fe2O3、FeO、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中氧化剂与还原剂物质的量之比为___ 。
(2)NaClO3在浸出液中发生反应的离子方程式为___ 。
(3)加入Na2CO3调pH至5.2,目的是___ ;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为___ 。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___ 、___ 、过滤、洗涤、减压烘干等过程。
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___ 。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Co(OH)2 | 7.6 | 9.2 |
| Al(OH)3 | 4.0 | 5.2 |
| Mn(OH)2 | 7.7 | 9.8 |
(2)NaClO3在浸出液中发生反应的离子方程式为
(3)加入Na2CO3调pH至5.2,目的是
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,
(5)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
| 温度范围/℃ | 150~210 | 290~320 |
| 固体质量/g | 4.41 | 2.41 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



