解答题-原理综合题 较难0.4 引用1 组卷159
锰元素在溶液中主要以Mn2+(很浅的肉色,近乎无色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)形式存在,MnO2不溶于稀硫酸。
(紫色)形式存在,MnO2不溶于稀硫酸。
(1)草酸与高锰酸钾在酸性条件下可以发生化学反应。请写出离子方程式:_______ 。
(2)现有0.00lmol/L的酸性KMnO4溶液和0.0lmol/L的草酸溶液,为探讨外界条件对化学反应速率的影响,设计的实验方案如下表:
①通过实验①、②可探究_______ 对反应速率的影响,支持该结论的实验现象是_______ 。
②通过实验①、③可探究草酸的浓度对反应速率的影响,表中Vx=_______ mL,理由是_______ 。
③若实验①5s后,颜色不再变化,用草酸的浓度变化来表示反应速率为_______ 。
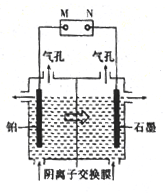
(3)电解法制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,中间用阴离子交换膜将两室隔开,电解过程中阴离子向右移动,一段时间后两极均有气体生成。
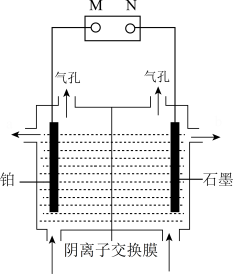
①单质锰将会在_______ 电极上析出(填"铂"或"石墨")。
②写出发生在阴极上的所有电极反应方程式_______ 。
(1)草酸与高锰酸钾在酸性条件下可以发生化学反应。请写出离子方程式:
(2)现有0.00lmol/L的酸性KMnO4溶液和0.0lmol/L的草酸溶液,为探讨外界条件对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | 温度/℃ | ||
KMnO4溶液 | 水 | H2C2O4溶液 | ||
① | 40.0 | 0.0 | 20.0 | 25 |
② | 40.0 | 0.0 | 20.0 | 60 |
③ | 40.0 | Vx | 10.0 | 25 |
②通过实验①、③可探究草酸的浓度对反应速率的影响,表中Vx=
③若实验①5s后,颜色不再变化,用草酸的浓度变化来表示反应速率为
(3)电解法制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,中间用阴离子交换膜将两室隔开,电解过程中阴离子向右移动,一段时间后两极均有气体生成。

①单质锰将会在
②写出发生在阴极上的所有电极反应方程式
20-21高二·重庆九龙坡·阶段练习
类题推荐
锰元素是重要的过渡元素,在工农业生产中发挥不可替代的作用。已知锰元素在溶液中主要以Mn2+(很浅的肉色,近乎无色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)的形式存在,MnO2不溶于稀硫酸。请回答下列问题:
(紫色)的形式存在,MnO2不溶于稀硫酸。请回答下列问题:
(1)已知过氧化氢在二氧化锰催化作用下分解放出氧气的反应机理如下: ,
, 。
。
①H2O2的电子式为___________ ,在第二步反应中作___________ 剂(填“氧化”或“还原”
②第一步反应生成1molO2,转移的电子数为___________ NA。
(2)二氧化锰和高锰酸钾都能与浓盐酸反应制备氯气,高锰酸钾制备氯气的化学方程式为___________ ,生成等质量的氯气,反应消耗二氧化锰和高锰酸钾的质量比为___________ 。
(3)现以0.001mol·L-1酸性KMnO4溶液和0.01mol·L-1草酸溶液探究外界条件对化学反应速率的影响,某实验小组设计的实验方案如下表:
①草酸与酸性高锰酸钾溶液反应的产物之一是Mn2+,写出该反应的离子方程式___________ 。
②通过实验①、②可探究草酸的浓度对反应速率的影响,表中a=___________ 。
(4)电解锰酸钾溶液制备高锰酸钾的装置如图所示,电解过程中阳离子向右移动。
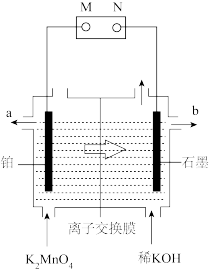
①锰酸钾转化为高锰酸钾时的实验现象为___________ 。
②b口流出的物质为___________ (填化学式)。
(1)已知过氧化氢在二氧化锰催化作用下分解放出氧气的反应机理如下:
①H2O2的电子式为
②第一步反应生成1molO2,转移的电子数为
(2)二氧化锰和高锰酸钾都能与浓盐酸反应制备氯气,高锰酸钾制备氯气的化学方程式为
(3)现以0.001mol·L-1酸性KMnO4溶液和0.01mol·L-1草酸溶液探究外界条件对化学反应速率的影响,某实验小组设计的实验方案如下表:
| 实验序号 | 体积V/mL | 温度/℃ | ||
| KMnO4溶液 | 水 | H2C2O4溶液 | ||
| ① | 40.0 | 0.0 | 20.0 | 25 |
| ② | 40.0 | a | 10.0 | 25 |
②通过实验①、②可探究草酸的浓度对反应速率的影响,表中a=
(4)电解锰酸钾溶液制备高锰酸钾的装置如图所示,电解过程中阳离子向右移动。

①锰酸钾转化为高锰酸钾时的实验现象为
②b口流出的物质为
化学是一门以实验为基础的科学,其中控制变量思想在探究实验中有重要应用,下列实验对影响化学反应速率的因素进行探究。实验方案:现有0.01 mol/L酸性KMnO4溶液和0.1 mol/L草酸(化学式H2C2O4,是一种二元弱酸)溶液,为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
请回答下列问题:
(1)请书写此过程的离子反应方程式:___________ 。
(2)通过实验①、③可探究草酸的浓度对反应速率的影响,表中Vx=___________ mL。
(3)为探究温度对反应速率的影响应选择实验序号为___________ 的实验进行对比,其实验现象是___________ 。
(4)实验①中t min时溶液褪色,用草酸表示的反应速率v(H2C2O4)=___________ 。
(5)甲同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸溶液与酸性高锰酸钾溶液迅速混合后,开始一段时间溶液颜色变化不明显,但不久后突然褪色。针对上述现象,甲同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想的可能原因是:___________ 。
| 实验序号 | 体积V/mL | 温度/℃ | ||
| KMnO4溶液 | 水 | H2C2O4溶液 | ||
| ① | 4.0 | 0.0 | 4.0 | 25 |
| ② | 4.0 | 0.0 | 4.0 | 60 |
| ③ | 4.0 | Vx | 3.0 | 25 |
(1)请书写此过程的离子反应方程式:
(2)通过实验①、③可探究草酸的浓度对反应速率的影响,表中Vx=
(3)为探究温度对反应速率的影响应选择实验序号为
(4)实验①中t min时溶液褪色,用草酸表示的反应速率v(H2C2O4)=
(5)甲同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸溶液与酸性高锰酸钾溶液迅速混合后,开始一段时间溶液颜色变化不明显,但不久后突然褪色。针对上述现象,甲同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想的可能原因是:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 MnO2+2MnO4-+4OH-。
MnO2+2MnO4-+4OH-。 ”表示溶液中阴离子移动的方向。铂电极的电极反应式为
”表示溶液中阴离子移动的方向。铂电极的电极反应式为