解答题-实验探究题 适中0.65 引用1 组卷214
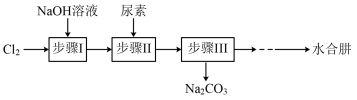
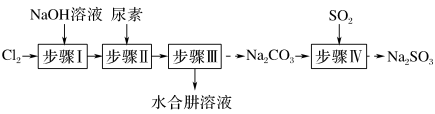
肼又称联氨, 是重要的化工原料。某兴趣小组以尿素为原料按下列流程制备水合肼(N2H4·H2O),并进一步得到无水肼。
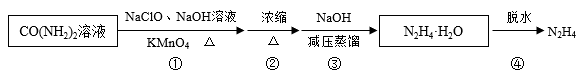
已知:水合肼:沸点(118.5℃),有强还原性,属于弱碱(类似NH3·H2O);
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
N2H4·H2O+2I2=N2↑+4HI+H2O
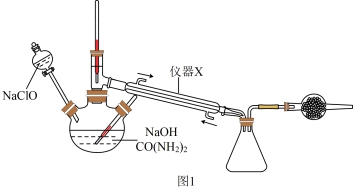
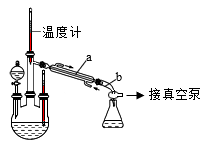
实验装置如图所示:
请回答:
(1)仪器a的名称为_________ 。
(2)工业上还可以用NH3和NaClO溶液反应制取水合肼,写出反应的化学方程式______________ 。
(3)用化学用语解释N2H4的水溶液呈碱性的原因___________________ 。
(4)下列操作或描述不正确的是________ 。
A.步骤①,NaOH和NaClO的混合溶液可以用过量的NaOH溶液中通入Cl2来制备
B.步骤①,需要使用温度计控制温度
C.步骤①,为了使CO(NH2)2完全反应,分液漏斗中盛放CO(NH2)2溶液
D.步骤③,采用减压蒸馏可使产品在较低温度下气化,避免温度过高而分解
(5)称取10.00 g水合肼样品,加水配成1000 mL溶液,从中取出10.00 mL溶液与0.200 mol/L的I2溶液反应。如完全反应时消耗I2溶液16.40 mL,则样品中水合肼(N2H4·H2O)的质量分数为_________ 。

已知:水合肼:沸点(118.5℃),有强还原性,属于弱碱(类似NH3·H2O);
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
N2H4·H2O+2I2=N2↑+4HI+H2O
实验装置如图所示:

请回答:
(1)仪器a的名称为
(2)工业上还可以用NH3和NaClO溶液反应制取水合肼,写出反应的化学方程式
(3)用化学用语解释N2H4的水溶液呈碱性的原因
(4)下列操作或描述不正确的是
A.步骤①,NaOH和NaClO的混合溶液可以用过量的NaOH溶液中通入Cl2来制备
B.步骤①,需要使用温度计控制温度
C.步骤①,为了使CO(NH2)2完全反应,分液漏斗中盛放CO(NH2)2溶液
D.步骤③,采用减压蒸馏可使产品在较低温度下气化,避免温度过高而分解
(5)称取10.00 g水合肼样品,加水配成1000 mL溶液,从中取出10.00 mL溶液与0.200 mol/L的I2溶液反应。如完全反应时消耗I2溶液16.40 mL,则样品中水合肼(N2H4·H2O)的质量分数为
19-20高二·浙江·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网