解答题-原理综合题 适中0.65 引用2 组卷119
(1)已知下列热化学方程式:
a.H2(g)+ O2(g)═H2O(l);△H=-285.8kJ•mol-1
O2(g)═H2O(l);△H=-285.8kJ•mol-1
b.H2(g)+ O2(g)═H2O(g);△H=-241.8kJ•mol-1
O2(g)═H2O(g);△H=-241.8kJ•mol-1
c.CO(g)═C(s)+ O2(g);△H=+110.5kJ•mol-1
O2(g);△H=+110.5kJ•mol-1
d.C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
①上述反应中属于吸热反应的是________
②CO的燃烧热△H=________ 。表示CO燃烧热的热化学方程式为________ 。
③燃烧10g H2生成液态水,放出的热量为________ 。
(2)可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件。函数△G就是一个判断的依据:△G=△H-T△S式中T为反应的温度(开尔文温度,没有负值)。
①当一个反应的△G___________ 0(填“>”、“<”或“=”)时,反应一定能自发进行。
②当△H<0,△S<0,温度___________ (填“较高”或“较低”)时能自发反应。
a.H2(g)+
b.H2(g)+
c.CO(g)═C(s)+
d.C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
①上述反应中属于吸热反应的是
②CO的燃烧热△H=
③燃烧10g H2生成液态水,放出的热量为
(2)可以用反应的△H和△S的正、负来判断该反应自发进行的可能性和自发进行的条件。函数△G就是一个判断的依据:△G=△H-T△S式中T为反应的温度(开尔文温度,没有负值)。
①当一个反应的△G
②当△H<0,△S<0,温度
20-21高二上·宁夏石嘴山·期中
类题推荐
工业上利用N2和H2可以合成氨气,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列有关问题:
(1)已知:N2(g)+O2(g) 2NO(g) ΔH=akJ·mol-1
2NO(g) ΔH=akJ·mol-1
N2(g)+3H2(g) 2NH3(g) ΔH=bkJ·mol-1
2NH3(g) ΔH=bkJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH=ckJ·mol-1
2H2O(g) ΔH=ckJ·mol-1
写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式____ 。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+O2(g) 2NO(g) ΔH<0。
2NO(g) ΔH<0。
其化学平衡常数K与温度t的关系如表:
完成下列问题:
①比较K1、K2的大小:K1____ K2(填“>”“=”或“<”);
②在恒温恒容条件下判断该反应达到化学平衡状态的依据是____ (填序号)。
A.2v正(N2)=v逆(H2) B.2v正(H2)=3v逆(NH3)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)工业上生产尿素的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,10s反应达到平衡,此时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。10s内v(NH3)为
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,10s反应达到平衡,此时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。10s内v(NH3)为____ 。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为____ 。
(1)已知:N2(g)+O2(g)
N2(g)+3H2(g)
2H2(g)+O2(g)
写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+O2(g)
其化学平衡常数K与温度t的关系如表:
| t/K | 298 | 398 | 498 | …… |
| K/(mol·L-1) | 4.1×106 | K1 | K2 | …… |
①比较K1、K2的大小:K1
②在恒温恒容条件下判断该反应达到化学平衡状态的依据是
A.2v正(N2)=v逆(H2) B.2v正(H2)=3v逆(NH3)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)工业上生产尿素的化学方程式为2NH3(g)+CO2(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(g) +H2O(g);
CH3OH(g) +H2O(g);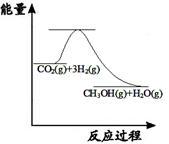

 2 NH3(g) △H =-92 kJ·mol-1
2 NH3(g) △H =-92 kJ·mol-1 CH3OH(g) +H2O(g);
CH3OH(g) +H2O(g);

 2 NH3(g) ΔH =-92 kJ·mol-1则a =
2 NH3(g) ΔH =-92 kJ·mol-1则a =

