解答题-原理综合题 适中0.65 引用4 组卷141
氮的化合物是重要的工业原料,也是主要的大气污染来源研究氮的化合物的反应具有重要意义。回答下列问题:
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61.25kJ,则该反应的热化学方程式为__ 。
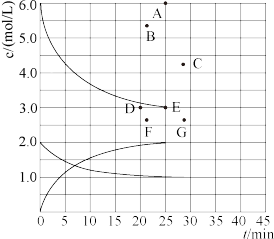
(2)在773K时,分别将2.00molN2和6.00molH2充入一个固定容积为1L的密闭容器中发生反应生成NH3气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
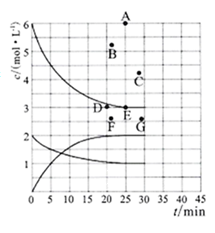
①下列能说明反应达到平衡状态的是__ 选填字母。
a.v正(N2)=v逆(H2)
b.体系压强不变
c.气体平均相对分子质量不变
d.气体密度不变
②在此温度下,若起始充入4.0molN2和12.0molH2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为__ (选填字母)。
(3)在373K时,向体积为2L的恒容真空容器中充入0.40molNO2发生如下反应:2NO2(g) N2O4(g)△H=-56.9kJ/mol。测得的NO2体积分数[φ(NO2)]与反应时间(t)的关系如表:
N2O4(g)△H=-56.9kJ/mol。测得的NO2体积分数[φ(NO2)]与反应时间(t)的关系如表:
①计算0~20min时,v(N2O4)=__ 。
②已知该反应v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时, =
=___ ;改变温度至T时,k1=k2,则T1__ 373K(填“>”、“<”或“=”)。
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61.25kJ,则该反应的热化学方程式为
(2)在773K时,分别将2.00molN2和6.00molH2充入一个固定容积为1L的密闭容器中发生反应生成NH3气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。

①下列能说明反应达到平衡状态的是
a.v正(N2)=v逆(H2)
b.体系压强不变
c.气体平均相对分子质量不变
d.气体密度不变
②在此温度下,若起始充入4.0molN2和12.0molH2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为
(3)在373K时,向体积为2L的恒容真空容器中充入0.40molNO2发生如下反应:2NO2(g)
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
②已知该反应v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,
2020·全国·模拟预测
类题推荐
氮的化合物既是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3催化还原法:原理如图所示
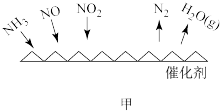
①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为___________ 。
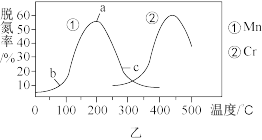
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_________ ;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是__________ 。
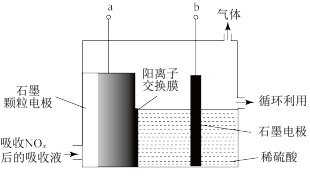
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为__________ 。
(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
①下列能说明反应达到平衡状态的是____ (选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为___ (选填字母)。
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)⇌N2O4(g) ∆H=-56.9kJ‧mol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
①计算0~20min时,v(N2O4)=____________ 。
②已知该反应v正(NO2)=k1‧c2(NO2),v逆(N2O4)=k2‧c(N2O4),其中k1、k2为速率常数,则373K时, =
=_________ ;改变温度至T1时,k1=k2,则T1_______ 373K(填“>”“<”或“=”)。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3催化还原法:原理如图所示


①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为

(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。

①下列能说明反应达到平衡状态的是
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)⇌N2O4(g) ∆H=-56.9kJ‧mol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=
②已知该反应v正(NO2)=k1‧c2(NO2),v逆(N2O4)=k2‧c(N2O4),其中k1、k2为速率常数,则373K时,
碳和氮的化合物是广泛的化工原料,回答下列问题:
I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________ 。
(2)该反应为_______________ 反应(填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________ 。
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______ ℃。
(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的浓度分别为2mol·L-1、2mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡向__________ 移动(填“正向”、“逆向”或“不”)。
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。
(1)在1000K下,在某恒容容器中发生下列反应:2NO2(g) 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图1所示。图中a点对应温度下,NO2的转化率是0.6。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图1所示。图中a点对应温度下,NO2的转化率是0.6。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
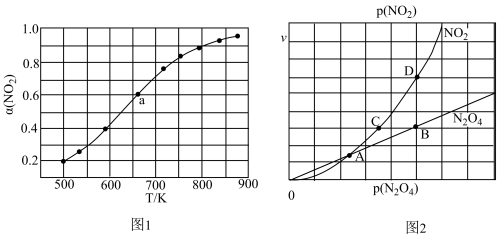
(2)对于反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图2所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图2所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________ ;在上图标出点中,指出能表示反应达到平衡状态的两个点__________ ,理由是__________________________ 。
I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为
(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的浓度分别为2mol·L-1、2mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡向
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。
(1)在1000K下,在某恒容容器中发生下列反应:2NO2(g)

(2)对于反应N2O4(g)
研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
则1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是________ 。
(2)N2O4与NO2转化的热化学方程式为N2O4(g) 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。
①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________ (填字母)。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色________ (填“变深”“变浅”或“不变”),判断理由______________________________________ 。
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式________ (用p总、各气体物质的量分数x表示);影响K的因素为________ 。
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正________________ (填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是________ 。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________ 。
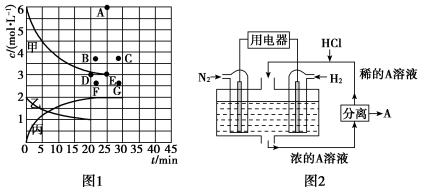
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是____________________ ,A是_______________________________ 。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
| 化学键 | N—H | N—N | N≡N | O—H |
| 键能/(kJ·mol-1) | 390 | 190 | 946 | 460 |
(2)N2O4与NO2转化的热化学方程式为N2O4(g)
 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是

(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


