解答题-实验探究题 较易0.85 引用1 组卷239
铝镁合金是飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_______________ 。
[实验步骤]
(1)称取10.8g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol∙L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥________ mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_______ (填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
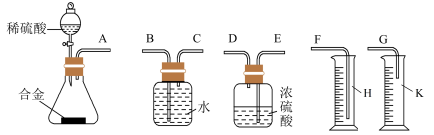
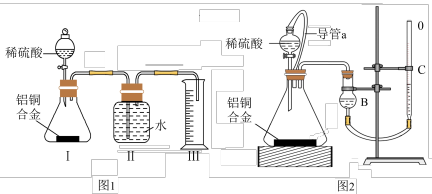
(1)同学们拟选用如图1实验装置完成实验:
你认为最简易的装置其连接顺序是A接___ ,___ 接___ (填接口字母,可不填满)。
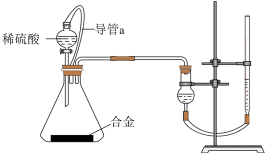
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图2所示的实验装置。
①实验前后右侧滴定管中液面读数分别为V1mL、V2mL,则产生氢气的体积为___ mL。(已知滴定管的零刻度在上方)
②若需确定产生氢气的量,还需测定的数据是___________ 。
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是
[实验步骤]
(1)称取10.8g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol∙L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用如图1实验装置完成实验:

你认为最简易的装置其连接顺序是A接
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图2所示的实验装置。
①实验前后右侧滴定管中液面读数分别为V1mL、V2mL,则产生氢气的体积为
②若需确定产生氢气的量,还需测定的数据是
20-21高一·河南商丘·期中
类题推荐
铝镁合金是飞机制造、化工生产等行业的重要材料。某研究性学习小组为测定某铝镁合金(不含其他元素)中铝的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
[方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的离子方程式是___ 。
[实验步骤]
(2)称取8.1g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol·L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥___ mL。
(3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将___ (填“偏高”、“偏低”或“无影响”)。
[方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
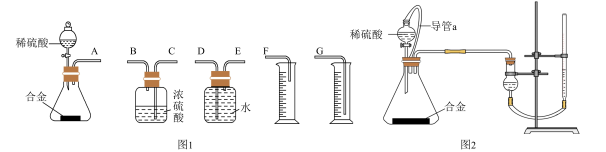
(4)同学们拟选用下列实验装置完成实验:
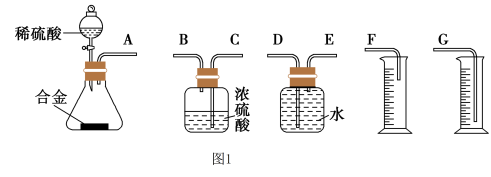
你认为最简易的装置其连接顺序是A接( ),( )接( ),( )接( )(填接口字母,注意:可不填满)___ 。
(5)仔细分析上述实验装置后,同学们认为会引起较大误差。于是他们设计了如图2所示的实验装置。与图2装置相比,用图1连接的装置进行实验时,若不考虑导管中液体体积的影响,测定铝镁合金中铝的质量分数将___ (填“偏大”、“偏小”或“无影响”).
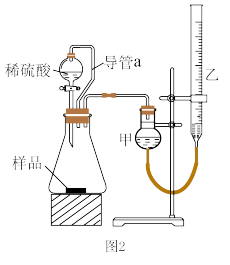
某同学提出该实验装置不够完善,应在甲和锥形瓶之间添加一个装有碱石灰的干燥装置。你的意见是___ (填“需要”或“不需要”)
(6)用图2装置进行实验时:为了较准确测量氢气的体积,在读反应前后量气管乙中液面的读数求其差值的过程中,应注意___(填字母编号)。
(7)图2装置进行实验,合金的质量为7.8g,测得氢气体积为8.96L(标准状况),则合金中铝的质量分数为___ (保留两位有效数字)。
[方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的离子方程式是
[实验步骤]
(2)称取8.1g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0mol·L-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥
(3)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将
[方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(4)同学们拟选用下列实验装置完成实验:

你认为最简易的装置其连接顺序是A接( ),( )接( ),( )接( )(填接口字母,注意:可不填满)
(5)仔细分析上述实验装置后,同学们认为会引起较大误差。于是他们设计了如图2所示的实验装置。与图2装置相比,用图1连接的装置进行实验时,若不考虑导管中液体体积的影响,测定铝镁合金中铝的质量分数将

某同学提出该实验装置不够完善,应在甲和锥形瓶之间添加一个装有碱石灰的干燥装置。你的意见是
(6)用图2装置进行实验时:为了较准确测量氢气的体积,在读反应前后量气管乙中液面的读数求其差值的过程中,应注意___(填字母编号)。
| A.冷却至室温 |
| B.等待片刻,待乙管中液面不再上升时立即读数 |
| C.读数时应移动右侧量气管,使甲乙两端液面相平 |
| D.视线与凹液面最低处相平 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网