解答题-实验探究题 适中0.65 引用2 组卷305
FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解
(1)制备无水氯化铁
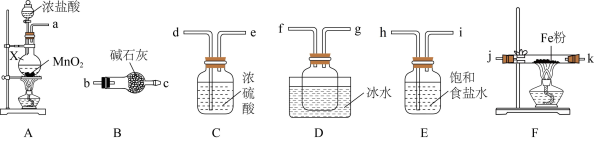
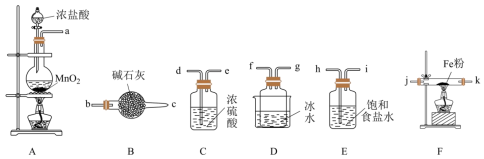
①仪器X的名称为______________ 。
②装置的连接顺序为a→______ → j,k →________ (按气流方向,用小写字母表示)。
③实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为____ 。
(2)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①____________
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)____ E(ii)(填“>”、 “<”或“=”,下同),平衡常数大小关系是:K(i)__________ K(ii)。
⑤另取5 mL l mol L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是
L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施是____ 。
(1)制备无水氯化铁

①仪器X的名称为
②装置的连接顺序为a→
③实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为
(2)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①
| 步骤 | 现象 | 结论 |
| Ⅰ.取5 mL1 mol⋅L−1 FeCl3溶液于试管中,通入SO2至饱和 | 溶液很快由黄色变为红棕色 | |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液 | 溶液中无明显光路 | ②红棕色物质不是 |
| Ⅲ将步骤Ⅰ中的溶液静置 | 1小时后,溶液逐渐变为浅绿色 | |
| IV.向步骤Ⅲ中溶液加入2滴K3[Fe(CN)6]溶液 | ③ | 溶液中含有Fe2+ |
⑤另取5 mL l mol
20-21高三上·山西运城·阶段练习
类题推荐  和
和 是
是 的两种重要的氯化物。
的两种重要的氯化物。
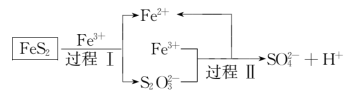
I.现代工业生产中常用电解 溶液的方法制取
溶液的方法制取 溶液,用于吸收有毒的H2S气体。
溶液,用于吸收有毒的H2S气体。
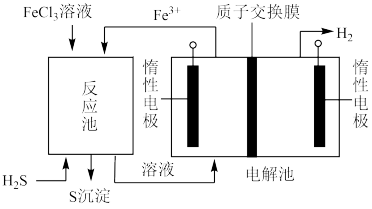
(1)工艺原理如图所示,回答下列问题:
①电解池中的总反应离子方程式___________ 。
②工艺中,___________ 溶液可以循环利用(填“ ”或“
”或“ ”)
”)
Ⅱ.探究 的各种平衡表现
的各种平衡表现
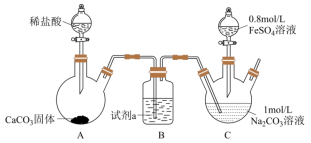
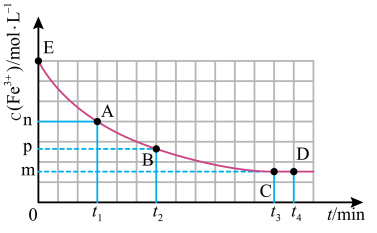
(2)25℃时,向40mL 的
的 溶液中一次性加入10mL
溶液中一次性加入10mL 的KSCN溶液,发生反应,混合溶液中
的KSCN溶液,发生反应,混合溶液中 与反应时间(t)的变化如图所示。下列说法正确的是___________。
与反应时间(t)的变化如图所示。下列说法正确的是___________。
(3) 溶液与的
溶液与的 反应体系中存在下列两种化学变化:
反应体系中存在下列两种化学变化:
(i) 与
与 发生络合反应生成
发生络合反应生成 (红棕色);
(红棕色);
(ii) 与
与 发生氧化还原反应,其离子方程式为①
发生氧化还原反应,其离子方程式为①___________ 。
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)___________ E(ii)(填“>”“<”或“=”下同),平衡常数大小关系;K(i)___________ K(ii)。
I.现代工业生产中常用电解

(1)工艺原理如图所示,回答下列问题:
①电解池中的总反应离子方程式
②工艺中,
Ⅱ.探究
(2)25℃时,向40mL

| A.该反应的离子方程式为 |
| B.E点对应的坐标为(0,0.04) |
| C. |
| D.若该反应是可逆反应,在25℃时平衡常数的数值为: |
(i)
(ii)
| 步骤 | 现象 | 结论 |
| I.取5mL | 溶液很快由黄色变为红棕色 | |
| Ⅱ.用激光笔照射步骤I中的红棕色溶液 | 溶液中无明显光路 | ②红棕色物质不是 |
| Ⅲ.将步骤I中的溶液静置 | 1小时后,溶液逐渐变为浅绿色 | |
| Ⅳ.向步骤Ⅲ中所得溶液加入2滴 | ③ | 溶液中含有 |
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网