解答题-实验探究题 适中0.65 引用1 组卷259
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O] 比 FeSO4稳定,不易被氧气氧化,常用于代替 FeSO4作分析试剂。某小组在实验室制备(NH4)2Fe(SO4)2·6H2O 并探究其分解产物。
Ⅰ.按以下流程制备硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]
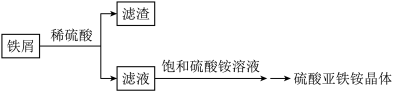
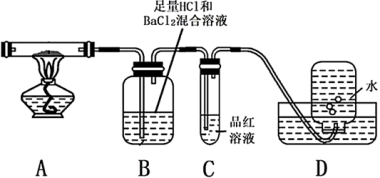
(1)铁屑溶于稀硫酸过程中,适当加热的目的是________ 。
(2)流程中,需将滤液转移到____ (填写仪器名称)中,迅速加入饱和硫酸铵溶液,直接加热蒸发混合溶液,观察到____ ,停止加热。
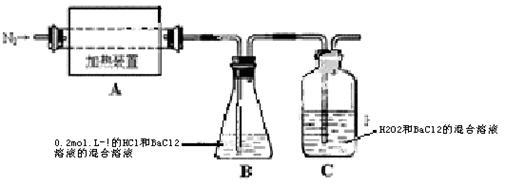
II.查阅资料可知硫酸亚铁铵晶体加热主要发生反应:(NH4)2Fe(SO4)2 — Fe2O3+ SO2↑+ NH3↑+ N2↑+ H2O但伴有副反应发生,生成少量SO3和O2。设计以下实验探究分解的产物:
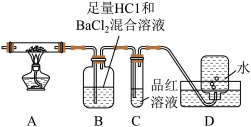
(3)配平,完整写出上述分解反应的化学方程式_______ 。
(4)加热过程,A 中固体逐渐变为________ 色。待晶体完全分解后,为验证A中残留物是否含有FeO,需选用的试剂有______ (填字母)。
A KSCN溶液 B 稀硫酸 C 浓盐酸 D 酸性KMnO4溶液
(5)B中有白色沉淀生成,写出生成该白色沉淀的离子方程式:_______ 。
(6)C的作用是___________ 。
(7)D中集气瓶能收集到氧气,________ (填“能”或“不能”)用带火星木条检验。
(8)上述反应结束后,继续证明分解产物中含有 NH3的方法是_______ 。
Ⅰ.按以下流程制备硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]

(1)铁屑溶于稀硫酸过程中,适当加热的目的是
(2)流程中,需将滤液转移到
II.查阅资料可知硫酸亚铁铵晶体加热主要发生反应:(NH4)2Fe(SO4)2 — Fe2O3+ SO2↑+ NH3↑+ N2↑+ H2O但伴有副反应发生,生成少量SO3和O2。设计以下实验探究分解的产物:

(3)配平,完整写出上述分解反应的化学方程式
(4)加热过程,A 中固体逐渐变为
A KSCN溶液 B 稀硫酸 C 浓盐酸 D 酸性KMnO4溶液
(5)B中有白色沉淀生成,写出生成该白色沉淀的离子方程式:
(6)C的作用是
(7)D中集气瓶能收集到氧气,
(8)上述反应结束后,继续证明分解产物中含有 NH3的方法是
20-21高三上·福建福州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网