解答题-原理综合题 适中0.65 引用1 组卷117
Ⅰ.常温下,如果取0.2 mol/LCH3COOH溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,试回答以下问题:
(1)写出该混合过程中所发生反应的离子方程式:__________________ ,混合溶液的pH=9的原因是:(用必要的文字和离子方程式表示)________________ 。
(2)该混合溶液中由水电离出的c(H+)和pH=9的NaOH溶液中由水电离出c(H+)的比值为_________ 。
(3)求该混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=_________ mol/L(代入数据,列出算式即可)
c(OH-)-c(CH3COOH)=_________ moL/L。
Ⅱ.(4)由表格中的电离平衡常数判断可以发生的反应是_________ (填字母序号)。
A.NaClO+NaHCO3=HClO+Na2CO3
B.2HClO+Na2CO3=2NaClO+CO2↑+H2O
C.2NaClO+CO2+H2O=2HClO+Na2CO3
D.NaClO+CO2+H2O=HClO+NaHCO3
(5)将同温度下等浓度的下列四种盐溶液:(已知常温下一水合氨的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=4.7×10-11)
A.NH4HCO3 B.NH4Cl C.(NH4)2SO4 D.CH3COONH4
按pH由大到小的顺序排列:_________ (填字母序号)。
(6)下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是_________ (填字母序号)。
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3 ⑤NaHCO3 ⑥高锰酸钾
A.③④ B.①③④ C.①②③④⑤ D.全部
(1)写出该混合过程中所发生反应的离子方程式:
(2)该混合溶液中由水电离出的c(H+)和pH=9的NaOH溶液中由水电离出c(H+)的比值为
(3)求该混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=
c(OH-)-c(CH3COOH)=
Ⅱ.(4)由表格中的电离平衡常数判断可以发生的反应是
| 化学式 | 常温下的电离常数 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
A.NaClO+NaHCO3=HClO+Na2CO3
B.2HClO+Na2CO3=2NaClO+CO2↑+H2O
C.2NaClO+CO2+H2O=2HClO+Na2CO3
D.NaClO+CO2+H2O=HClO+NaHCO3
(5)将同温度下等浓度的下列四种盐溶液:(已知常温下一水合氨的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=4.7×10-11)
A.NH4HCO3 B.NH4Cl C.(NH4)2SO4 D.CH3COONH4
按pH由大到小的顺序排列:
(6)下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3 ⑤NaHCO3 ⑥高锰酸钾
A.③④ B.①③④ C.①②③④⑤ D.全部
20-21高二上·山西长治·期中
类题推荐
根据要求回答下列问题。
(1)常温下,将某一元酸HA(甲、乙代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
从甲组实验结果分析,该混合溶液中离子浓度由大到小的顺序是___________ 。
(2)pH相同的①NaCN ②NaClO ③Na2S三种溶液,其物质的量浓度由大到小的顺序为___________ (填序号)。(已知:弱酸的电离平衡常数HCN:Ka=4×10-10;H2S:Ka1=1×10-7,Ka2=7×10-15;HClO:Ka=3×10-8 )
(3)可溶性铝盐常用作净水剂的原因:_______ (用离子方程式表示)。
(4)在常温下,0.1 mol﹒L-1一元酸HB溶液的 ,常温下,有c(H+)相同、体积相同的盐酸和酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
,常温下,有c(H+)相同、体积相同的盐酸和酸HB两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是______ (填字母)。(①表示盐酸,②表示HB)
a.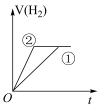 b.
b.  c.
c. 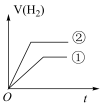 d.
d.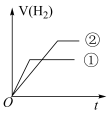
(5)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4 ④NH4Cl ⑤(NH4)2Fe(SO4)2 ,c( )由大到小顺序是
)由大到小顺序是___________ (用序号表示)。
(6)常温下,将0.2molH2C2O4加入300ml2mol/L的NaOH溶液中(假设溶液的体积不变),所得溶液的pH=a,则c(C2O )+2c(HC2O
)+2c(HC2O )+3c(H2C2O4)=
)+3c(H2C2O4)=_____ mol/L(用含a的代数式表示)。
(1)常温下,将某一元酸HA(甲、乙代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | 混合溶液的pH | ||
| 甲 | 0.2 | 0.1 | >7 |
| 乙 | 0.1 | 0.1 | =10 |
(2)pH相同的①NaCN ②NaClO ③Na2S三种溶液,其物质的量浓度由大到小的顺序为
(3)可溶性铝盐常用作净水剂的原因:
(4)在常温下,0.1 mol﹒L-1一元酸HB溶液的
a.
 b.
b.  c.
c.  d.
d.
(5)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4 ④NH4Cl ⑤(NH4)2Fe(SO4)2 ,c(
(6)常温下,将0.2molH2C2O4加入300ml2mol/L的NaOH溶液中(假设溶液的体积不变),所得溶液的pH=a,则c(C2O
按要求完成下列各小题
(1)25℃时,0.1mol·L-1NH4Cl溶液的pH________ 7(填“<”、“=”或“ >");其原因是_______________________________________________________ (用离子方程式表示);
(2)下列物质能导电且属于电解质的是________ (填序号)。
A.铁B.盐酸C.氯化钠晶体D.熔融氢氧化钠
(3)已知常温下部分弱电解质的电离平衡常数如下表:
常温下,pH相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液
其物质的量浓度由大到小的顺序是__________________ (填序号)
(4)25℃时,pH=4的NH4Cl溶液由水电离的c(OH-)=______________
(5)0.1mo/L的NaClO溶液和0.1mo/L的NaHCO3溶液中,c(ClO-)________ c(HCO3-)(填“>,<,=”),可使上述两种溶液pH相等的方法是________ (填代号)
a.向NaClO溶液中加适量的水
b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水
d.向NaHCO3溶液中加适量的NaOH
(6)向NaClO溶液中通入少量的CO2,所发生的离子方程式为____________________________ 。
(7)常温下,0.1mol/L的氨水和0.1mo/L的NH4Cl溶液等体积混合,通过计算判断混合溶液的酸碱性________________________________________________________________________________ 。
(8)不能证明HA是弱电解质的方法是( )
A.测得0.1mol/L HA溶液的pH > 1
B.测得NaA溶液的pH>7
C.pH=1的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别和相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
(1)25℃时,0.1mol·L-1NH4Cl溶液的pH
(2)下列物质能导电且属于电解质的是
A.铁B.盐酸C.氯化钠晶体D.熔融氢氧化钠
(3)已知常温下部分弱电解质的电离平衡常数如下表:
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
常温下,pH相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液
其物质的量浓度由大到小的顺序是
(4)25℃时,pH=4的NH4Cl溶液由水电离的c(OH-)=
(5)0.1mo/L的NaClO溶液和0.1mo/L的NaHCO3溶液中,c(ClO-)
a.向NaClO溶液中加适量的水
b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水
d.向NaHCO3溶液中加适量的NaOH
(6)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(7)常温下,0.1mol/L的氨水和0.1mo/L的NH4Cl溶液等体积混合,通过计算判断混合溶液的酸碱性
(8)不能证明HA是弱电解质的方法是
A.测得0.1mol/L HA溶液的pH > 1
B.测得NaA溶液的pH>7
C.pH=1的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别和相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
电离平衡常数是衡量弱电解质电离程度的量。已知如表数据(25℃):
(1)25℃,等浓度的以下三种溶液pH由大到小的顺序为_______ 。(填写序号)
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______ 。
(3)现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是_______。
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
①c_______ 0.2(填“>”“<”或“=”,下同)。该混合液中离子浓度c(A-)_______ c(Na+)。
②a组实验所得混合溶液中由水电离出的c(OH-)=_______ mol/L。写出该混合溶液中下列算式的精确结果:c(Na+) - c(A-) = _______ mol/L。
| 化学式 | 电离平衡常数 |
| HCN | Ka = 4.9×10-10 |
| CH3COOH | Ka = 1.8×10-5 |
| H2CO3 | Ka1 = 4.4×10-7,Ka2 = 4.7×10-11 |
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
(3)现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是_______。
| A.c(H+)>c(OH-) | B.c(H+)<c(OH-) |
| C.c(H+)+c(HCN)=c(OH-) | D.c(HCN)+c(CN-)=0.01mol/L |
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 反应后溶液pH |
| a | 0.1 | 0.1 | 8 |
| b | c | 0.2 | 7 |
②a组实验所得混合溶液中由水电离出的c(OH-)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


