解答题-原理综合题 适中0.65 引用2 组卷203
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1=akJ·mol−1
CO(g) + H2O (g)=CO2(g) + H2(g) ΔH2=bkJ·mol−1
2CO(g) + O2(g)=2CO2(g) ΔH3=ckJ·mol−1
反应CO2(g) + CH4(g)=2CO(g) + 2H2(g) 的ΔH=__ kJ·mol−1。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
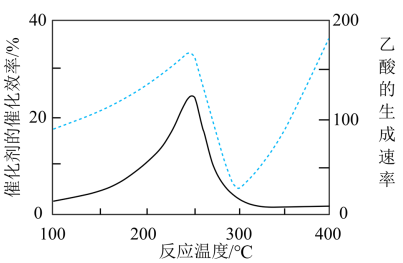
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因可能是___ 。
②为了提高该反应中CH4的转化率,可以采取的措施是___ 。
(3)以CO2为原料可以合成多种物质。
①利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1 mol Fe3O4,转移电子的物质的量为___ mol。
②以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图所示,b是电源的________ (填“正极”或“负极”),写出生成丙烯的电极反应式___ 。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1=akJ·mol−1
CO(g) + H2O (g)=CO2(g) + H2(g) ΔH2=bkJ·mol−1
2CO(g) + O2(g)=2CO2(g) ΔH3=ckJ·mol−1
反应CO2(g) + CH4(g)=2CO(g) + 2H2(g) 的ΔH=
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。

①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因可能是
②为了提高该反应中CH4的转化率,可以采取的措施是
(3)以CO2为原料可以合成多种物质。
①利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1 mol Fe3O4,转移电子的物质的量为
②以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图所示,b是电源的

20-21高三上·江苏南京·阶段练习
类题推荐
CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g) + CH4(g)⇌2CO(g) + 2H2(g)。平衡体系中各组分的体积分数如下表:
①此温度下该反应的平衡常数K=________________ 。
②已知:CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H=-890.3kJ•mol-1,CO(g) + H2O(g) = CO2(g) + H2(g) △H=+2.8kJ•mol-1,2CO(g) + O2(g) = 2CO2(g) △H=-566.0kJ•mol-1,反应CO2(g) + CH4(g)⇌2CO(g) + 2H2(g)的△H=_______ 。
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成为乙酸。
①在不同温度下,催化剂的催化效率与乙酸的生成速率的变化关系如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________ 。
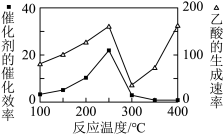
②为了提高该反应中CH4的转化率,可以采取的措施是__________________ 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________ 。
(3)以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成的。写出聚碳酸酯的结构简式:__________ 。
②以氢氧化钾水溶液作为电解质进行电解,CO2在铜电极上可转化为甲烷,电极反应式为____________ 。
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g) + CH4(g)⇌2CO(g) + 2H2(g)。平衡体系中各组分的体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H=-890.3kJ•mol-1,CO(g) + H2O(g) = CO2(g) + H2(g) △H=+2.8kJ•mol-1,2CO(g) + O2(g) = 2CO2(g) △H=-566.0kJ•mol-1,反应CO2(g) + CH4(g)⇌2CO(g) + 2H2(g)的△H=
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成为乙酸。
①在不同温度下,催化剂的催化效率与乙酸的生成速率的变化关系如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是

②为了提高该反应中CH4的转化率,可以采取的措施是
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为
(3)以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成的。写出聚碳酸酯的结构简式:
②以氢氧化钾水溶液作为电解质进行电解,CO2在铜电极上可转化为甲烷,电极反应式为
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250 ℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 ( g)+CH4(g)
g)+CH4(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
平衡体系中各组分体积分数如下表:
①此温度下该反应的平衡常数K=____________ 。
②已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO(g)+H2O (g)===CO2(g)+H2 (g) =2.8 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) =-566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的ΔH=
2CO(g)+2H2(g) 的ΔH=_____________ 。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是___________________________________________________________________ 。
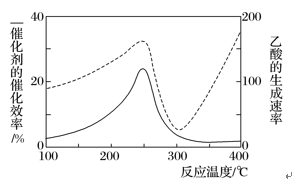
②为了提高该反应中CH4的转化率,可以采取的措施是____________________________________ 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为________________________________________________ 。
(3)①Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是________ (填字母)。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li 4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是
4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_________________________________________ 。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O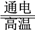 CO+H2+O2
CO+H2+O2
高温电解技术能高效实现反应A,工作原理示意图如下:
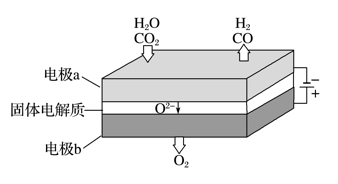
CO2在电极a放电的反应式是________________________________________________ 。
(1)250 ℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (
 g)+CH4(g)
g)+CH4(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=
②已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO(g)+H2O (g)===CO2(g)+H2 (g) =2.8 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) =-566.0 kJ·mol-1
反应CO2(g)+CH4(g)
 2CO(g)+2H2(g) 的ΔH=
2CO(g)+2H2(g) 的ΔH=(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是

②为了提高该反应中CH4的转化率,可以采取的措施是
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为
(3)①Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li
 4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是
4SiO4,Li4SiO4用于吸收、释放CO2。原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O
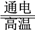 CO+H2+O2
CO+H2+O2高温电解技术能高效实现反应A,工作原理示意图如下:

CO2在电极a放电的反应式是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



