解答题-原理综合题 适中0.65 引用1 组卷384
H2S广泛存在于许多燃气和工业废气中,脱除其中的H2S既可回收硫又可防止产生污染。回答下列问题:
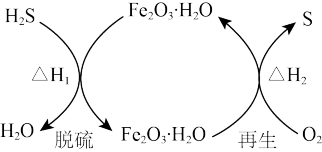
(1)Tretford氧化法脱H2S,包括H2S的吸收、氧化析硫、焦钒酸钠的氧化等。
①焦钒酸钠的化学式为Na2V4O9,其中钒元素的化合价为_______ ;
②已知H2S、H2CO3的电离常数如下表所示:
纯碱溶液吸收H2S的离子方程式为______________ 。
(2)Claus氧化回收硫的反应原理为:2H2S(g)+O2(g)=2S(g)+2H2O(g) △H1
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H2=-1124 kJ/mol
2H2S(g) +SO2(g)=S(g) +2H2O(g) △H3=- 233 kJ/mol
则△H1=_______ kJ/mol。
(3)H2S分解反应2H2S(g) 2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:

①该反应的△H_______ (填“>”或“<”)0。
②在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是___________ ;在约1100 °C时,有无Al2O3催化,其转化率几乎相等,是因为___________ 。
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数,列出含p的代数式)。
(1)Tretford氧化法脱H2S,包括H2S的吸收、氧化析硫、焦钒酸钠的氧化等。
①焦钒酸钠的化学式为Na2V4O9,其中钒元素的化合价为
②已知H2S、H2CO3的电离常数如下表所示:
| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1.1×10-12 |
| H2CO3 | 4.3×10-7 | 5.61×10-11 |
纯碱溶液吸收H2S的离子方程式为
(2)Claus氧化回收硫的反应原理为:2H2S(g)+O2(g)=2S(g)+2H2O(g) △H1
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H2=-1124 kJ/mol
2H2S(g) +SO2(g)=S(g) +2H2O(g) △H3=- 233 kJ/mol
则△H1=
(3)H2S分解反应2H2S(g)

①该反应的△H
②在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=
2020·广西北海·一模
类题推荐
中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯。
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式__________________ 。
(2)H2S分解反应2H2S(g) 2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:

①在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是___________ 。
②在约1100 °C时,有无Al2O3催化,其转化率几乎相等,是因为___________ 。
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数,列出含p的代数式)。
(3)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。
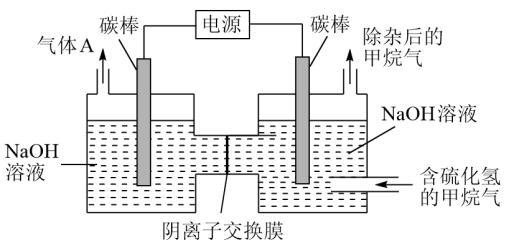
通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中左端碳棒上的电极反应式为_____ ,右池中的c(NaOH):c(Na2S)_____ (填“增大”、“ 基本不变”或“减小)。
已知:常温下,HCN的电离常数Ka=4.9×10-10,H2S的电离常Ka1=1.3×10−7,Ka2=7.0×10−15,Ksp(MnS)=1.4×10−15
(4)常温下,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_______________ 。
(5)常温下,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L−1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=_____ 。
| 物质 | 燃烧热(kJ/mol) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.5 |
(2)H2S分解反应2H2S(g)

①在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是
②在约1100 °C时,有无Al2O3催化,其转化率几乎相等,是因为
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=
(3)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。

通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中左端碳棒上的电极反应式为
已知:常温下,HCN的电离常数Ka=4.9×10-10,H2S的电离常Ka1=1.3×10−7,Ka2=7.0×10−15,Ksp(MnS)=1.4×10−15
(4)常温下,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为
(5)常温下,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L−1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 COCl2(g)。 在1 L恒温恒容密闭容器中充入2.5 mol CO和1.5 mol Cl2,在催化剂作用下发生反应,测得CO及COCl2的物质的量随时间变化如图所示:
COCl2(g)。 在1 L恒温恒容密闭容器中充入2.5 mol CO和1.5 mol Cl2,在催化剂作用下发生反应,测得CO及COCl2的物质的量随时间变化如图所示:

 C6H12O6+6H2O+12S↓,该反应的能量转化形式是
C6H12O6+6H2O+12S↓,该反应的能量转化形式是