解答题-原理综合题 适中0.65 引用2 组卷203
甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=_______ kJ/mol。
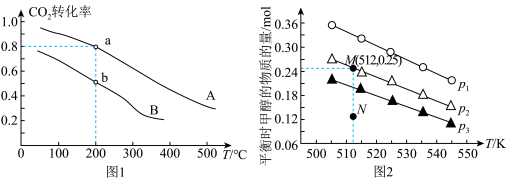
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。
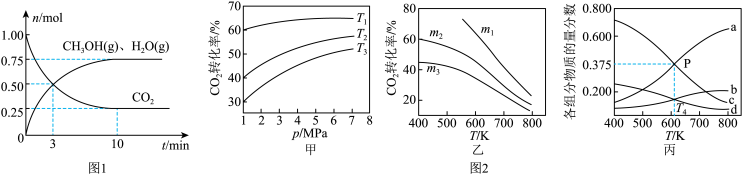
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
②下列措施不能使CO2的平衡转化率增大的是_______ (填序号)。
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m= 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。
①图甲中投料比相同,温度从高到低的顺序为_______ 。
②图乙中m1、m2、m3从大到小的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
Ⅱ.甲醇的应用
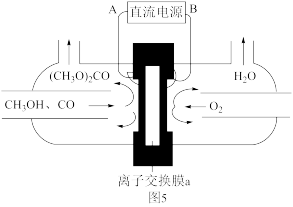
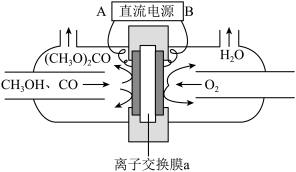
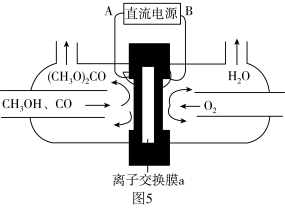
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为_______ (填“阳膜”或“阴膜”),阳极的电极反应式为_______ 。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m=
①图甲中投料比相同,温度从高到低的顺序为
②图乙中m1、m2、m3从大到小的顺序为
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为
Ⅱ.甲醇的应用
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为

20-21高三上·陕西汉中·阶段练习
类题推荐
完成下列问题
(1)甲烷临氧耦合CO,重整反应有:
①2CH4(g)+O2(g) 2CO(g)+4H2(g)
2CO(g)+4H2(g)  =-71.4J·mol-1
=-71.4J·mol-1
②CH4(g)+CO2(g) 2CO+2H2(g)
2CO+2H2(g)  = +247.0kJ·mol-1
= +247.0kJ·mol-1
则CO的燃烧热△H=_______ 。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应:CH4(g)+CO2(g) 2CO+2H2(g),CO2的平衡转化率如表所示。
2CO+2H2(g),CO2的平衡转化率如表所示。
①下列条件能说明反应达到平衡状态的是_______ (填序号)。
A. v正(CH4) = 2v逆( CO)
B.容器内各物质的浓度满足16c( CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的平均分子量不再变化
D.容器内混合气体密度不再变化
②达到平衡时,容器II内CO2的平衡转化率_______ 50% (填“>”“=”或“<”)。
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)
C2H5OH(g)+3H2O(g)  <0。设m为起始时的投料比,即m=
<0。设m为起始时的投料比,即m= 。通过实验得到图象:
。通过实验得到图象:
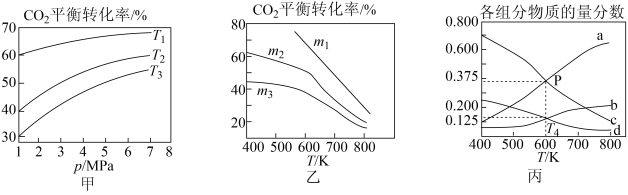
①图甲中投料比相同,温度从低到高的顺序为_______ 。
②图乙中m1、m2、m3从小到大的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为_______ (用平衡分压代替平衡浓度计算,分压=总压x物质的量分数,代入数据,不用计算)。
(4)将标准状况下的CO2 4.48L通入0.3mo/L、1L NaOH溶液中恰好完全反应,所得溶液中的离子浓度大小关系为_______ 。
(1)甲烷临氧耦合CO,重整反应有:
①2CH4(g)+O2(g)
②CH4(g)+CO2(g)
则CO的燃烧热△H=
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应:CH4(g)+CO2(g)
| 容器 | 起始物质的量/mol | CO2的平衡转化率 | |||
| CH4 | CO2 | CO | H2 | ||
| Ⅰ | 4 | 4 | 0 | 0 | 50% |
| Ⅱ | 4 | 4 | 4 | 4 | |
A. v正(CH4) = 2v逆( CO)
B.容器内各物质的浓度满足16c( CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的平均分子量不再变化
D.容器内混合气体密度不再变化
②达到平衡时,容器II内CO2的平衡转化率
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)

①图甲中投料比相同,温度从低到高的顺序为
②图乙中m1、m2、m3从小到大的顺序为
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为
(4)将标准状况下的CO2 4.48L通入0.3mo/L、1L NaOH溶液中恰好完全反应,所得溶液中的离子浓度大小关系为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


 及512K时,图中N点v正<v逆
及512K时,图中N点v正<v逆
 )。
)。