解答题-原理综合题 适中0.65 引用3 组卷90
随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l)△H<0
5N2(g)+6H2O(l)△H<0
(1)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO)=2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是__ 。
A.c(NH3)︰c(NO)=2︰3
B.n(NH3)︰n(N2)不变
C.容器内压强不变
D.容器内混合气体的密度不变
E.1molN—H键断裂的同时,生成1molO—H键
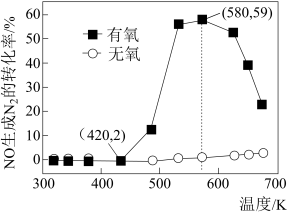
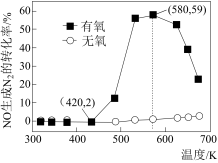
(2)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示。
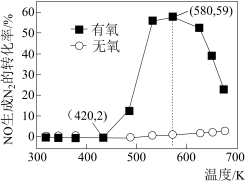
①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=__ ;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是__ 。
(1)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO)=2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是
A.c(NH3)︰c(NO)=2︰3
B.n(NH3)︰n(N2)不变
C.容器内压强不变
D.容器内混合气体的密度不变
E.1molN—H键断裂的同时,生成1molO—H键
(2)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示。

①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是
20-21高二上·山东泰安·期中
类题推荐
氮氧化物对环境及人类活动影响日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
反应①; 4NH3(g)+ 6NO(g) 5N2(g)+ 6H2O(l) ΔH1
5N2(g)+ 6H2O(l) ΔH1
已知: 4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(1) ΔH2= -902kJ/mol
4NO(g)+ 6H2O(1) ΔH2= -902kJ/mol
N2(g)+ O2(g) = 2NO(g) ΔH3= +182.4kJ/mol
(1)ΔH1=___________ kJ/mol,已知反应①的ΔS= -0.5 kJ·mol-1 ·K-1,则常温下(298K),该反应___________ (填“能”或“不能”)自发。
(2)温度为400K时,在恒容密闭容器中按照n(NH3):n(NO)=1:3充入反应物,发生上述反应①,下列能判断该反应达到平衡状态的是___________(填标号)。
(3)某研究小组将4molNH3、6mol NO和一定量的O2充入2L密闭容器中,在催化剂表面发生反应,NO的转化率随温度变化的情况如图所示:
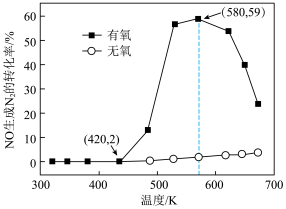
从图像可以看到,在有氧条件下,温度升高到580K之后,NO生成N2的转化率开始降低,可能的原因是___________ 。
Ⅱ.在一定条件下,用H2还原NO的反应为2H2(g)+ 2NO(g)= N2(g)+ 2H2O(g)ΔH<0,为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为2L的刚性密闭容器中通入amol H2和3mol NO发生反应,实验结果如图所示:
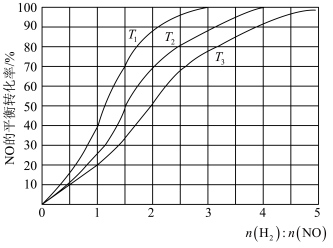
(4)①反应温度T1、T2、T3从低到高的关系为___________ 。
②T1温度下,充入H2、NO分别为3mol、3mol,容器内的起始压强为pkPa,反应进行到10min时达到平衡,0~10min 内N2的平均反应速率为___________ mol·L-1·min-1,该反应的平衡常数Kp=___________ kPa-1。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
反应①; 4NH3(g)+ 6NO(g)
已知: 4NH3(g)+ 5O2(g)
N2(g)+ O2(g) = 2NO(g) ΔH3= +182.4kJ/mol
(1)ΔH1=
(2)温度为400K时,在恒容密闭容器中按照n(NH3):n(NO)=1:3充入反应物,发生上述反应①,下列能判断该反应达到平衡状态的是___________(填标号)。
| A.c(H2O)保持不变 |
| B.混合气体的密度保持不变 |
| C.混合气体的平均摩尔质量保持不变 |
| D.有3molN-H键断裂的同时,有6mol O-H键生成 |

从图像可以看到,在有氧条件下,温度升高到580K之后,NO生成N2的转化率开始降低,可能的原因是
Ⅱ.在一定条件下,用H2还原NO的反应为2H2(g)+ 2NO(g)= N2(g)+ 2H2O(g)ΔH<0,为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为2L的刚性密闭容器中通入amol H2和3mol NO发生反应,实验结果如图所示:

(4)①反应温度T1、T2、T3从低到高的关系为
②T1温度下,充入H2、NO分别为3mol、3mol,容器内的起始压强为pkPa,反应进行到10min时达到平衡,0~10min 内N2的平均反应速率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网