解答题-原理综合题 适中0.65 引用1 组卷66
研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol−1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=_____ kJ·mol−1,利于该反应自发进行的条件是_______ (选填“高温”或“低温”)。
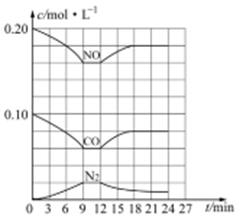
(2)将0.20mol NO和0.10mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g),反应过程中部分物质的浓度变化如图所示:
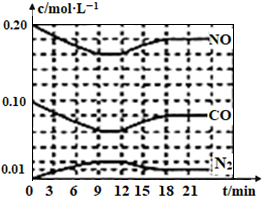
①反应从开始到9min时,用CO2表示该反应的速率是_______ (保留2位有效数字)
②第12min时改变的条件是__________ (填“升温或降温”)。
③第18min时建立新的平衡,此温度下的平衡常数为_________ (列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____ 移动(填“正向”、“逆向”或“不”)。
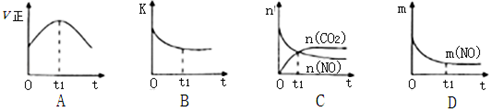
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是__ (填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol−1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=
(2)将0.20mol NO和0.10mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)

①反应从开始到9min时,用CO2表示该反应的速率是
②第12min时改变的条件是
③第18min时建立新的平衡,此温度下的平衡常数为
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

20-21高二上·山西临汾·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

 2NO2(g)
2NO2(g)