解答题-实验探究题 适中0.65 引用2 组卷453
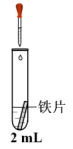
某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验 i 中的现象是_____ 。
②用化学用语解释实验i中的现象:_____ 。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_____ 。
②进行下列实验,在实验几分钟后的记录如下:
a.以上实验表明:在_____ 条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净) 后再进行实验 iii,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl-的作用是_____ 。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验 ii 结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是_____ (填 字母序号)。
| 装置 | 分别进行的操作 | 现象 |
 | i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
| ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
①实验 i 中的现象是
②用化学用语解释实验i中的现象:
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是
②进行下列实验,在实验几分钟后的记录如下:
| 实验 | 滴管 | 试管 | 现象 |
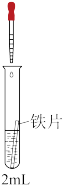 | 0.5 mol·L-1 K3[Fe(CN)6] 溶液 | iii. 蒸馏水 | 无明显变化 |
| iv. 1.0 mol·L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
| v. 0.5 mol·L-1Na2SO4溶液 | 无明显变化 |
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净) 后再进行实验 iii,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl-的作用是
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验 ii 结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是
| 实验 | 试剂 | 现象 |
| A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
| B | 酸洗后的铁片、K3[Fe(CN)6]和 NaCl 混合溶液(未除O2) | 产生蓝色沉淀 |
| C | 铁片、K3[Fe(CN)6]和NaCl 混合溶液(已除O2) | 产生蓝色沉淀 |
| D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除 O2) | 产生蓝色沉淀 |
20-21高二上·北京海淀·期中
类题推荐
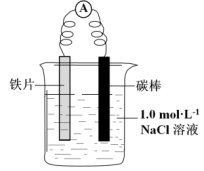
金属腐蚀现象遍及国民经济和国防建设各个领域,危害十分严重。近几十年来,金属的腐蚀与防腐已成为一门独立的综合性边缘学科。某实验小组利用如图所示装置进行铁的电化学腐蚀原理及防护的探究实验:
(1)已知,Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀。
小组同学认为以下两种检验方法,均能证明铁发生了吸氧腐蚀。
①用电极反应式解释实验i中的现象:___________ 。
②查阅资料:K3[Fe(CN)6]具有氧化性。有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是___________ 。
③为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,进行下列实验,几分钟后的记录如下:
a. 以上实验表明:在Cl-存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是___________ 。
(2)实验二:乙小组同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
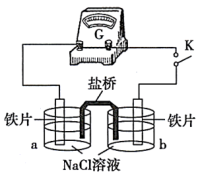
①分别取少量容器a、b中的溶液于试管中,滴加K3[Fe(CN)6]溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做___________ 极。
②加热后,电流计指针发生偏转的原因可能是___________ 。
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应式___________ 。
(1)已知,Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀。
小组同学认为以下两种检验方法,均能证明铁发生了吸氧腐蚀。
| 装置 | 分别进行的操作 | 现象 |
 | i.连好装置一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 |
| ii.连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
②查阅资料:K3[Fe(CN)6]具有氧化性。有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是
③为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,进行下列实验,几分钟后的记录如下:
| 实验 | 胶头滴管 | 试管 | 现象 |
 | 0.5 mol/L K3[Fe(CN)6]溶液 | iii.蒸馏水 | 无明显变化 |
| iv. | 铁片表面产生大量蓝色沉淀 | ||
| v. | 无明显变化 |
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是
(2)实验二:乙小组同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。

①分别取少量容器a、b中的溶液于试管中,滴加K3[Fe(CN)6]溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做
②加热后,电流计指针发生偏转的原因可能是
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应式
某化学兴趣小组设计了如下实验,探究铁的电化学腐蚀及防护原理。
(1)甲同学利用下图装置,进行铁的电化学腐蚀原理探究。
查阅资料:1.Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀。
2.K3[Fe(CN)6]具有氧化性。
①用电极反应式解释实验ⅱ中的现象:_______ 。
②乙同学认为仅通过ⅲ中现象不能证明铁发生了电化学腐蚀,理由是_______ 。
③为验证猜想,乙同学设计了ⅳ、ⅴ、ⅵ三组对比实验,并记录如下:
a.以上实验表明:在Cl−存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl−的存在对反应的影响:乙同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅵ,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl−的作用是_______ 。
④结合上述两位同学的实验探究,请你改进甲同学步骤ⅲ的操作:_______ ,以证明铁发生了电化学腐蚀。
(2)丙同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
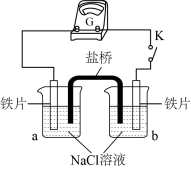
实验检测表明:容器a中的溶液产生了Fe2+,而容器b中的溶液不存在Fe2+。则:容器b中铁片做_______ 极(填:“正”或“负”)。加热后,电流计指针发生偏转的原因可能是_______ 。
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下, Fe钝化形成致密Fe3O4氧化膜,则阳极的电极反应式为_______ 。
(1)甲同学利用下图装置,进行铁的电化学腐蚀原理探究。
| 装置 | 实验步骤及操作 | 现象 |
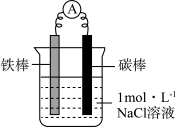 | ⅰ.连好装置,观察 | 电流表指针偏转 |
| ⅱ.一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 | |
| ⅲ.一段时间后,向烧杯中滴加铁氰化钾 (K3[Fe(CN)6])溶液 | 铁片表面产生蓝色沉淀 |
2.K3[Fe(CN)6]具有氧化性。
①用电极反应式解释实验ⅱ中的现象:
②乙同学认为仅通过ⅲ中现象不能证明铁发生了电化学腐蚀,理由是
③为验证猜想,乙同学设计了ⅳ、ⅴ、ⅵ三组对比实验,并记录如下:
| 实验 | 滴管 | 试管 | 现象 |
 | 0.5 mol·L−1 K3[Fe(CN)6] 溶液 | ⅳ.蒸馏水 | 无明显变化 |
| ⅴ. 1.0 mol·L−1 NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
| ⅵ.0.5 mol·L−1 Na2SO4溶液 | 无明显变化 |
b.为探究Cl−的存在对反应的影响:乙同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅵ,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl−的作用是
④结合上述两位同学的实验探究,请你改进甲同学步骤ⅲ的操作:
(2)丙同学向如图所示装置的容器a、b中分别加入30 mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。

实验检测表明:容器a中的溶液产生了Fe2+,而容器b中的溶液不存在Fe2+。则:容器b中铁片做
(3)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下, Fe钝化形成致密Fe3O4氧化膜,则阳极的电极反应式为
某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
(l)小组同学认为以上两种检验方法,均能证明铁发生了电化学腐蚀。
①实验i中的现象是________ 。
②写出实验b中生成蓝色沉淀的离子方程式:_______ 。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_______ 。
(3)实验二:乙小组同学向如图所示装置的容器a、b中分别加入30mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。
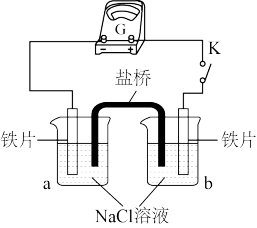
分别取少量容器a、b中的溶液于试管中,滴加 溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,写出容器b中的电极反应式
溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,写出容器b中的电极反应式________ 。
装置 | 分别进行的操作 | 现象 |
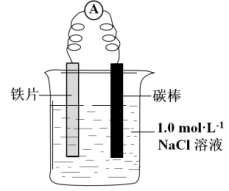 | i.连好装置一段时间后,向烧杯中滴加酚酞 | |
| ii.连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
①实验i中的现象是
②写出实验b中生成蓝色沉淀的离子方程式:
(2)查阅资料:K3[Fe(CN)6]具有氧化性。据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是
(3)实验二:乙小组同学向如图所示装置的容器a、b中分别加入30mL3.5%的NaCl溶液,闭合K,电流计指针未发生偏转。加热容器a,电流计指针向右偏转。

分别取少量容器a、b中的溶液于试管中,滴加
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


