解答题-工业流程题 较难0.4 引用3 组卷533
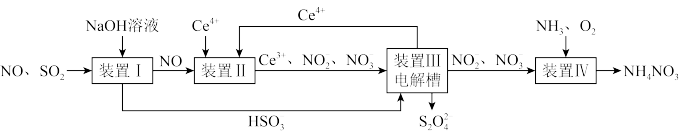
图1
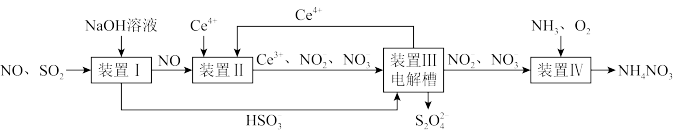
(1)装置Ⅰ中生成
(2)各含硫微粒(
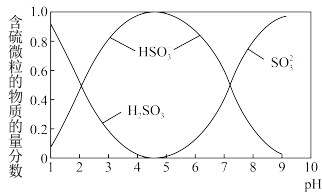
图2
①下列说法正确的是
a.
b.
c.为获得尽可能纯的
②向
(3)装置Ⅱ中,酸性条件下,NO被
(4)已知进入装置Ⅳ的溶液中,
19-20高二·全国·课时练习
知识点:氧化还原反应方程式的配平应用电离平衡分析生活中实例盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理盐溶液中离子浓度大小的比较 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。
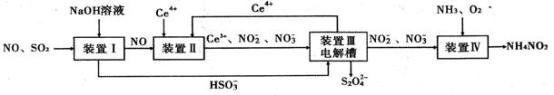
请回答下列问题:
(1)装置I中生成HSO-3的离子方程式为_____________________________________ 。
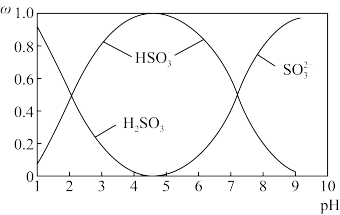
(2)含硫各微粒(H2SO3、HSO-3和SO2-3)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。
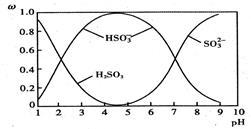
①下列说法正确的是_________ (填标号)。
②向pH = 5的NaHSO3溶液中滴加一定浓度的 CaCl2溶液,溶液中出现浑浊,其pH 降为2 ,用化学平衡移动原理解释溶液 pH 降低的原因__________ 。
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO-2离子方程式______________________ 。
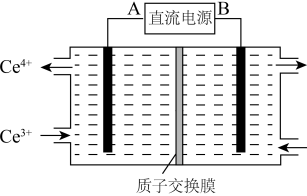
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
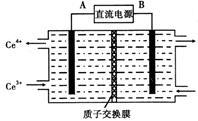
图中A为电源的_____ (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为__________ 。
(5)已知进入装置Ⅳ的溶液中NO-2的浓度为 0.75 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为_________ L 。

请回答下列问题:
(1)装置I中生成HSO-3的离子方程式为
(2)含硫各微粒(H2SO3、HSO-3和SO2-3)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。

①下列说法正确的是
| A.pH = 7时,溶液中c( Na+) < c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数K2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH = 9时溶液中 c(OH-)=" c" (H+) + c(HSO-3)+ 2c(H2SO3) |
②向pH = 5的NaHSO3溶液中滴加一定浓度的 CaCl2溶液,溶液中出现浑浊,其pH 降为2 ,用化学平衡移动原理解释溶液 pH 降低的原因
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO-2离子方程式
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

图中A为电源的
(5)已知进入装置Ⅳ的溶液中NO-2的浓度为 0.75 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网