填空题 适中0.65 引用1 组卷74
工业常用铁钼氧化物作催化剂,用甲醇空气氧化法制甲醛,反应过程涉及如下反应:
(有关数据均在298K时测定)
反应Ⅰ: ,
,
反应Ⅱ:
反应Ⅲ: ,
,
反应温度对甲醇氧化反应的影响如图所示。

(1)用反应Ⅲ制甲醛要比直接用反应Ⅰ制甲醛优越,原因是___________________________________________ 。
(2)生产时,要控制 为0.4左右,目的是
为0.4左右,目的是__________________________ (试从反应热和反应适宜的温度思考)。
(3)下列说法不正确的是__________________________ 。
A.甲醇的转化率接近100%的原因是反应Ⅲ属于完全反应
B.氢气的摩尔燃烧热为‒241.8kJ•mol‒1
C.600K以后甲醛产率下降的原因可能是温度升高导致甲醛发生热分解反应
(有关数据均在298K时测定)
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
反应温度对甲醇氧化反应的影响如图所示。

(1)用反应Ⅲ制甲醛要比直接用反应Ⅰ制甲醛优越,原因是
(2)生产时,要控制
(3)下列说法不正确的是
A.甲醇的转化率接近100%的原因是反应Ⅲ属于完全反应
B.氢气的摩尔燃烧热为‒241.8kJ•mol‒1
C.600K以后甲醛产率下降的原因可能是温度升高导致甲醛发生热分解反应
19-20高二·全国·课时练习
类题推荐
化学反应的过程,既是物质的转化过程,也是化学能与热、电等其他形式能量的转化过程。化学反应所提供的能量大促进了社会的发展,所以与研究化学反应中的物质变化一样,研究化学反应中的能量变化同样具有重要意义。
(1)某化学兴趣小组利用反应Zn+2FeCl3=ZnCl2+2FeCl2,设计了如图所示的原电池装置。
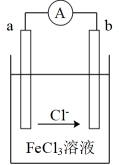
①b电极为_______ 极(填“正”或“负”)。
②a电极反应式为_______ ,发生_______ (填“氧化”或“还原”)反应。
③若电路中有0.4mol电子通过时,溶液质量增加_______ g。
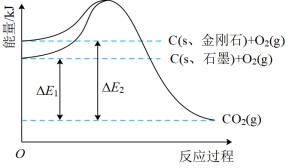
(2)如下图,在通常状况下,金刚石和石墨相比_______ (填“金刚石”或“石墨”)更稳定。石墨和金刚石之间的转化是_______ (填“物理”或“化学”)变化。
(3)已知一些化学键的键能数据如表所示:
请根据键能数据计算:CH4(g)和F2(g)反应生成CF4(g)和HF(g)的ΔH=_______ 。
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用CO2生产甲醇燃料的方法:
已知:①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ·mol-1
②CH3OH(g)=CH3OH(1) ΔH=-bkJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ·mol-1
④H2O(g)=H2O(1) ΔH=-dkJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为_______ 。
(1)某化学兴趣小组利用反应Zn+2FeCl3=ZnCl2+2FeCl2,设计了如图所示的原电池装置。

①b电极为
②a电极反应式为
③若电路中有0.4mol电子通过时,溶液质量增加
(2)如下图,在通常状况下,金刚石和石墨相比

(3)已知一些化学键的键能数据如表所示:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/kJ·mol-1 | 414 | 489 | 565 | 155 |
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用CO2生产甲醇燃料的方法:
已知:①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ·mol-1
②CH3OH(g)=CH3OH(1) ΔH=-bkJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ·mol-1
④H2O(g)=H2O(1) ΔH=-dkJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为
工业制硝酸的主要反应为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l)△H
(1)已知氢气的燃烧热为△H=﹣285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=_____ 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
①反应在第2min到第4min时,O2的平均反应速率为_____ 。
②反应在第6min时改变了条件,改变的条件可能是_____ (填序号).
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是_____ (填序号).
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
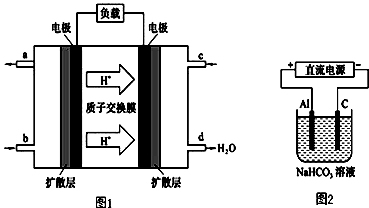
(3)某研究所组装的CH2=CH2﹣O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为_____ 。
②该电池负极的电极反应式为:_____ 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:_____ (用相关的离子方程式表示)。
(1)已知氢气的燃烧热为△H=﹣285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
①反应在第2min到第4min时,O2的平均反应速率为
②反应在第6min时改变了条件,改变的条件可能是
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH2=CH2﹣O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式为:
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:

化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是_____(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。
已知:
计算可得:
_____ 
若 水蒸气转化为液态水放出
水蒸气转化为液态水放出 的热量,则反应
的热量,则反应 的反应热为
的反应热为_____ , 的燃烧热为
的燃烧热为_____
已知
②根据上述数据, 和
和 本身具有的能量最低的是
本身具有的能量最低的是_____
③ 的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出
的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式_____
(1)下列反应中,属于吸热反应的是_____(填字母)。
| A. | B.甲烷的燃烧反应 |
| C. | D.锌与盐酸反应 |
①通过化学键的键能计算。
已知:
| 化学键种类 | |||||
| 键能 | 436 | 498 | 463.4 | 432 | 366 |
若
已知
②根据上述数据,
③
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


