解答题-实验探究题 0.4 引用1 组卷275
氯化亚铜晶体呈白色,不溶于水、乙醇及稀硫酸,露置于潮湿空气中易被氧化。氯化铜、氯化亚铜是重要的化工原料。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下。(已知:CuCl溶于NaCl的浓溶液可生成CuCl ,CuCl
,CuCl 的溶液用水稀释后可生成CuCl沉淀)
的溶液用水稀释后可生成CuCl沉淀)
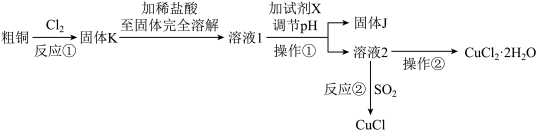
按要求回答下列问题:
(1)“操作①”调节溶液的pH范围为3.2≤pH<5.6,便于将Fe3+ 转化为Fe(OH)3沉淀除去,加入的“试剂X”可以是__________ 。
A CuO B NH3·H2O C NaOH溶液 D Cu2(OH)2CO3
(2)“反应②”是向溶液2中加入食盐并通入SO2可生成CuCl ,CuCl
,CuCl 的溶液用水稀释后可生成CuCl沉淀,过滤、洗涤、干燥密封包装即得产品,据此回答下列问题:
的溶液用水稀释后可生成CuCl沉淀,过滤、洗涤、干燥密封包装即得产品,据此回答下列问题:
①写出向溶液2中加入食盐并通入SO2可生成CuCl 的离子方程式
的离子方程式__________ 。
②用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却。于70℃真空干燥的目的是_____________________ 。
(3)在氯化氢气流中得到CuCl2·2H2O固体的“操作②”具体步骤为________ 、过滤、洗涤。
(4)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.100mol·L-1 硫酸铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
则样品中CuCl的纯度为________ 。
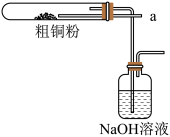
(5)如图所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为___________ 。

按要求回答下列问题:
(1)“操作①”调节溶液的pH范围为3.2≤pH<5.6,便于将Fe3+ 转化为Fe(OH)3沉淀除去,加入的“试剂X”可以是
A CuO B NH3·H2O C NaOH溶液 D Cu2(OH)2CO3
(2)“反应②”是向溶液2中加入食盐并通入SO2可生成CuCl
①写出向溶液2中加入食盐并通入SO2可生成CuCl
②用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却。于70℃真空干燥的目的是
(3)在氯化氢气流中得到CuCl2·2H2O固体的“操作②”具体步骤为
(4)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.100mol·L-1 硫酸铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 20.35 | 20.05 | 19.95 |
(5)如图所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为

20-21高三上·福建龙岩·期中


