解答题-实验探究题 适中0.65 引用1 组卷122
原电池是将化学能转化为电能的装置,某兴趣小组利用数据采集器和传感器等仪器对原电池进行实验探究。
I.能量变化探究
将上表的现象和结论补充完整
(1)_____________
(2)__________ 、__________
II.原电池电压影响因素的测定
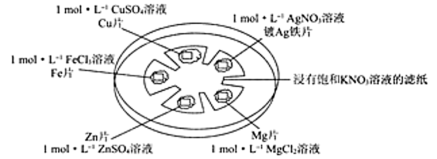
如图所示,在培养皿中进行微型实验,用浸有饱和KNO3溶液的滤纸充当盐桥,在滤纸间隔位置放置金属片,并滴三滴相应溶液,用电压传感器的两个探头分别与不同的金属表面接触形成闭合回路,测定电压。
(3)准确配制一定物质的量浓度的溶液时,操作X应在__________ (填字母)之间。
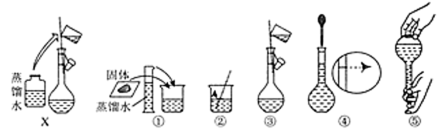
A.②③ B.③④ C.④⑤
(4)以上五种金属的活动性由活泼到不活泼的顺序为_________________ 。
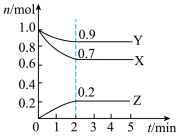
(5)实验条件下,连接不同金属片时所得数据见下表,表中Y极代表__________ (填“正”或“负”)极,预测表中Ag和Zn相连接时,测得电压的数值a可能的范围为____________ ;Fe和Mg相连接时,Z极的电极反应式为__________ ,Y极的电极反应式为____________ 。
I.能量变化探究
| 实验操作 | 数据及图象 | 现象与结论 |
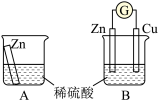
| 将60mL1mol/LCuSO4溶液置于100mL烧杯中,向其中加入1g镁粉 | 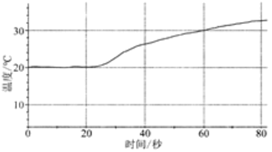 | (1)反应过程中,化学能直接转化为 能; |
| 将60mL1mol/LCuSO4溶液置于100mL烧杯中,平行插入铜片和镁片,与电流传感器形成闭合回路 | 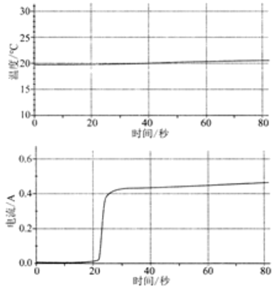 | (2)体系温度变化很小,原因是 ;反应过程中,镁片和铜片的质量变化分别为: ; |
(1)
(2)
II.原电池电压影响因素的测定
如图所示,在培养皿中进行微型实验,用浸有饱和KNO3溶液的滤纸充当盐桥,在滤纸间隔位置放置金属片,并滴三滴相应溶液,用电压传感器的两个探头分别与不同的金属表面接触形成闭合回路,测定电压。

(3)准确配制一定物质的量浓度的溶液时,操作X应在

A.②③ B.③④ C.④⑤
(4)以上五种金属的活动性由活泼到不活泼的顺序为
(5)实验条件下,连接不同金属片时所得数据见下表,表中Y极代表
| Y极 | Z极 | 测得电压/V |
| Ag | Fe | 1.009 |
| Ag | Zn | a |
| Ag | Mg | 2.114 |
| Fe | Zn | 0.473 |
| Fe | Mg | 1.111 |
| Zn | Mg | 0.636 |
20-21高三上·河南洛阳·阶段练习
类题推荐
海洋中有丰富的NaCl资源。研究表明,氯离子的侵入是造成钢筋混凝土腐蚀的主要原因(Na+对腐蚀无影响)。海砂经淡化后,Cl-的含量达到一定标准才能作建筑用砂。某合作学习小组猜测Cl-会加快金属与盐溶液或酸溶液的反应速率。
(1)工业上通过电解饱和NaCl溶液制Cl2的离子方程式为_____ 。
(2)实验室用如图所示装置模拟工业上制Cl2。检验产生的Cl2的操作及现象是_____ 。

(3)探究Cl-是否会加快金属与盐溶液的反应速率。
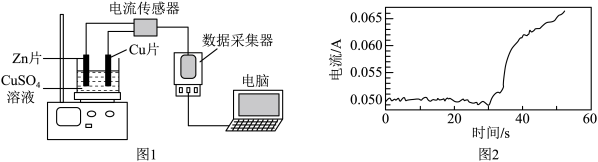
①小组同学利用图1所示装置进行探究。当Zn-Cu原电池工作约30s后,向电池槽内加入少量NaCl固体,电流随时间的变化如图2所示。甲同学认为加入NaCl固体后电流强度增大并不能说明Cl-会加快金属与盐溶液的反应速率,其理由可能是_____ 。
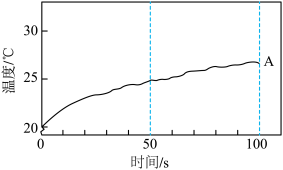
②乙同学利用温度传感器进行探究。分别取20mL0.1mol/LCuSO4溶液于A、B两个100mL烧杯中;向B烧杯中加入5gNaCl固体,使其溶解。在相同温度下,分别往两个烧杯中加入相同的用砂纸打磨过的镁条,采集温度数据,得出Cl-会加快金属与盐溶液的反应速率。已知0-100sA烧杯中溶液温度随时间的变化如图所示,请在答题卡相应位置画出0~100sB烧杯中溶液温度随时间的变化情况(100s时反应仍在进行)_____ 。
(4)探究Cl-是否会加快金属与酸溶液的反应速率。小组同学的实验记录如表:
其中,t1>t2,t1>t3。
①由实验I和实验II_____ (填“能”或“不能”)推知Cl-会加快金属与酸溶液的反应速率,理由是_____ 。
②小组同学一致认为,由实验I和实验III可推知Cl-会加快金属与酸溶液的反应速率,则实验III中,a处填_____ ,b处填_____ 。
(5)提出一种合理的降低海砂中Cl-含量的方法:_____ 。
(1)工业上通过电解饱和NaCl溶液制Cl2的离子方程式为
(2)实验室用如图所示装置模拟工业上制Cl2。检验产生的Cl2的操作及现象是

(3)探究Cl-是否会加快金属与盐溶液的反应速率。
①小组同学利用图1所示装置进行探究。当Zn-Cu原电池工作约30s后,向电池槽内加入少量NaCl固体,电流随时间的变化如图2所示。甲同学认为加入NaCl固体后电流强度增大并不能说明Cl-会加快金属与盐溶液的反应速率,其理由可能是

②乙同学利用温度传感器进行探究。分别取20mL0.1mol/LCuSO4溶液于A、B两个100mL烧杯中;向B烧杯中加入5gNaCl固体,使其溶解。在相同温度下,分别往两个烧杯中加入相同的用砂纸打磨过的镁条,采集温度数据,得出Cl-会加快金属与盐溶液的反应速率。已知0-100sA烧杯中溶液温度随时间的变化如图所示,请在答题卡相应位置画出0~100sB烧杯中溶液温度随时间的变化情况(100s时反应仍在进行)

(4)探究Cl-是否会加快金属与酸溶液的反应速率。小组同学的实验记录如表:
| 实验序号 | Zn片 | 酸 | 其他试剂 | 生成VmLH2的时间 |
| I | 完全相同 | 100mL0.1mol/L硫酸溶液 | — | t1 |
| II | 100mL0.2mol/L盐酸 | — | t2 | |
| III | 100mLamol/L硫酸溶液 | 少量b | t3 |
①由实验I和实验II
②小组同学一致认为,由实验I和实验III可推知Cl-会加快金属与酸溶液的反应速率,则实验III中,a处填
(5)提出一种合理的降低海砂中Cl-含量的方法:
为了更好地利用化学反应中的物质变化和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和进行的程度等。
Ⅰ.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验:利用Cu、Fe、Mg和不同浓度的硫酸溶液(0.5 mol/L、2 mol/L、18.4 mol/L),设计实验方案来研究影响反应速率的因素。
甲同学的实验报告如表:
(1)甲同学表中的实验步骤②为___________ 。
(2)甲同学的实验目的是___________ 。
(3)乙同学为了更精确地研究浓度对反应速率的影响,设计了实验,为完成实验应选用的药品除了金属镁外,还需要选择___________ 。
(4)乙同学在实验中应该测定的数据是___________ 。
Ⅱ.人们利用原电池原理制作了多种电池,以满足不同的需求。现提供纯锌片、纯铜片和500 mL0.4 mol/LH2SO4溶液、导线、1000 mL量筒,试用如图装置测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量(a、b为可上下移动的金属片)。

(5)如图所示,装置气密性良好,且1000 mL量筒中已充满了水,实验开始时,先用导线连接a、b,然后先将金属片___________ (填“a”或“b”)插入溶液中。
(6)a电极的材料为___________ ,其电极反应式为___________ 。
(7)当量筒中收集到672 mL(已折算为标准状况下)气体时,通过导线的电子的物质的量为___________ 。
Ⅰ.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验:利用Cu、Fe、Mg和不同浓度的硫酸溶液(0.5 mol/L、2 mol/L、18.4 mol/L),设计实验方案来研究影响反应速率的因素。
甲同学的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol/L硫酸溶液于三支试管中 ②___________ | 反应速率:Fe>Cu,Cu不反应 | 金属的性质越活泼,反应速率越快 |
(2)甲同学的实验目的是
(3)乙同学为了更精确地研究浓度对反应速率的影响,设计了实验,为完成实验应选用的药品除了金属镁外,还需要选择
(4)乙同学在实验中应该测定的数据是
Ⅱ.人们利用原电池原理制作了多种电池,以满足不同的需求。现提供纯锌片、纯铜片和500 mL0.4 mol/LH2SO4溶液、导线、1000 mL量筒,试用如图装置测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量(a、b为可上下移动的金属片)。

(5)如图所示,装置气密性良好,且1000 mL量筒中已充满了水,实验开始时,先用导线连接a、b,然后先将金属片
(6)a电极的材料为
(7)当量筒中收集到672 mL(已折算为标准状况下)气体时,通过导线的电子的物质的量为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网