解答题-实验探究题 适中0.65 引用3 组卷165
Ⅰ.已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
下列结论中正确的是_________ 。
A.碳的燃烧热等于110.5kJ·mol-1
B.①的反应热为221kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ·mol-1
D.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:
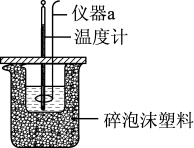
①用量筒量取50mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)仪器a的名称是_____________________ 。
(2)反应过程中NaOH溶液的浓度为0.55mol·L-1,不能使用0.50mol·L-1 NaOH的原因是_________________ 。
(3)倒入NaOH和盐酸溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边一次滴入
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为____________ 。
(5)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸所测中和热的数值并不相等,从它们的离子方程式分析,所测中和热的数值并不相等的理由是____________________ 。
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
下列结论中正确的是
A.碳的燃烧热等于110.5kJ·mol-1
B.①的反应热为221kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ·mol-1
D.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)仪器a的名称是
(2)反应过程中NaOH溶液的浓度为0.55mol·L-1,不能使用0.50mol·L-1 NaOH的原因是
(3)倒入NaOH和盐酸溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边一次滴入
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(5)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸所测中和热的数值并不相等,从它们的离子方程式分析,所测中和热的数值并不相等的理由是
20-21高二上·河北邢台·阶段练习
类题推荐
化学反应的能量变化通常表现为热量的变化,因此反应热的研究对于化学学科发展具有重要意义。
Ⅰ.已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
下列结论中正确的是_________ 。
A.碳的燃烧热等于110.5kJ·mol-1
B.①的反应热为221kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ·mol-1
D.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:
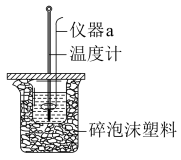
①用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)仪器a的名称是_______ 。烧杯间填满碎泡沫塑料的作用是________ 。
(2)配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平、烧杯、钥匙、镊子、玻璃棒、量筒以及______ 。
(3)实验中改用80mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_____ (填“相等”“不相等”)。反应过程中NaOH溶液的浓度为0.55mol·L-1不是0.50mol·L-1 的原因是_________ 。用Ba(OH)2溶液和硫酸代替上述试剂,所测中和热的数值_________ 。(填“偏大”、“偏小”或“不变”)
(4)倒入NaOH和盐酸溶液的正确操作是______ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边一次滴入
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为_________ 。
(6)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
Ⅰ.已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
下列结论中正确的是
A.碳的燃烧热等于110.5kJ·mol-1
B.①的反应热为221kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ·mol-1
D.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
Ⅱ.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)仪器a的名称是
(2)配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平、烧杯、钥匙、镊子、玻璃棒、量筒以及
(3)实验中改用80mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
(4)倒入NaOH和盐酸溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边一次滴入
(5)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(6)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.3 | 20.5 | 25.6 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



