解答题-实验探究题 适中0.65 引用2 组卷174
实验室常用浓硫酸的溶质质量分数为98%,密度为1.84 g·cm-3。
(1)此浓硫酸的物质的量浓度是_______________ 。
(2)配制480 mL 0.5 mol·L-1的硫酸,需以上浓硫酸_________ mL(精确到0.1位)。
(3)用浓硫酸配制该稀硫酸需要以下哪些步骤(按操作顺序填写序号):____________ 。
①计算 ②装瓶 ③量取一定体积的浓硫酸 ④洗涤
⑤移液 ⑥稀释 ⑦定容 ⑧摇匀
(4)某实验小组用0.55 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热的测定。
①写出表示中和热的热化学方程式:__________________________ 。
②某实验小组取100 mL NaOH溶液和50 mL 硫酸溶液进行实验测定,计算出该反应的反应热ΔH=-53.5 kJ·mol-1,与-57.3 kJ·mol-1有偏差,产生偏差的原因不可能是_____ (填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请回答下列问题:
①判断滴定终点的方法是________________________________________ 。
②下列操作中可能使所测NaOH溶液的浓度数值偏低的是____ (填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
③某学生根据3次实验分别记录有关数据如表所示:
依据表中数据列式计算该NaOH溶液的物质的量浓度__________________ 。
(1)此浓硫酸的物质的量浓度是
(2)配制480 mL 0.5 mol·L-1的硫酸,需以上浓硫酸
(3)用浓硫酸配制该稀硫酸需要以下哪些步骤(按操作顺序填写序号):
①计算 ②装瓶 ③量取一定体积的浓硫酸 ④洗涤
⑤移液 ⑥稀释 ⑦定容 ⑧摇匀
(4)某实验小组用0.55 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热的测定。
①写出表示中和热的热化学方程式:
②某实验小组取100 mL NaOH溶液和50 mL 硫酸溶液进行实验测定,计算出该反应的反应热ΔH=-53.5 kJ·mol-1,与-57.3 kJ·mol-1有偏差,产生偏差的原因不可能是
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请回答下列问题:
①判断滴定终点的方法是
②下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
③某学生根据3次实验分别记录有关数据如表所示:
| 滴定次数 | 待测NaOH溶液的 体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
20-21高三上·宁夏银川·阶段练习
类题推荐
I、某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。回答下列问题:
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是_______ 。
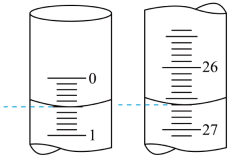
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为_______ mL。
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算可得该NaOH溶液的物质的量浓度为_______ mol/L(保留四位有效数字)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______ (填字母)。
II、某实验小组用氢氧化钠溶液和0.50mol/L硫酸溶液进行中和热的测定
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则计算得中和热△H=_______ (取小数点后一位)。
(6)上述实验结果与-57.3kJ/mol有偏差,产生偏差的原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

(3)某学生根据3次实验分别记录有关数据如下表:
| 测定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L硫酸的体积/L | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______ (填字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
II、某实验小组用氢氧化钠溶液和0.50mol/L硫酸溶液进行中和热的测定
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则计算得中和热△H=
(6)上述实验结果与-57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
I、某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。回答下列问题:
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是___________ 。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为___________ mL。

(3)某学生根据3次实验分别记录有关数据如表:
依据上表数据计算可得该NaOH溶液的物质的量浓度为___________ mol·L-1(保留四位有效数字)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是___________(填字母)。
II、某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。实验装置如图所示。
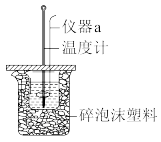
(5)仪器a的名称是___________ 。
(6)取50mLNaOH溶液和30mL硫酸溶液进行实验,测得起止温度差的平均值为4.0°C.近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·°C)。则计算得中和热△H=___________ (取小数点后一位)。
(7)上述实验结果与-57.3kJ/mol有偏差,产生偏差的原因可能是___________ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

(3)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1硫酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是___________(填字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
II、某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。实验装置如图所示。

(5)仪器a的名称是
(6)取50mLNaOH溶液和30mL硫酸溶液进行实验,测得起止温度差的平均值为4.0°C.近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·°C)。则计算得中和热△H=
(7)上述实验结果与-57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
Ⅰ、某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。回答下列问题:
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是_______ 。
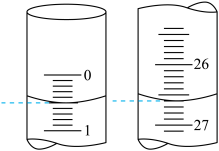
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则滴定结束时的读数为___________ mL,所用硫酸溶液的体积为_______ mL。
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算可得该NaOH溶液的物质的量浓度为___ mol·L-1(保留四位有效数字)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____ (填字母)。
A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸
B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.锥形瓶用水洗涤后,用待测液润洗
(5)酸碱中和滴定原理也可用于其它类型的滴定。如:一种测定水样中Br-的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1 mol/L AgNO3溶液(过量),充分摇匀。
③用c2mol/L KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL。
计算该水样中Br-的物质的量浓度为_______ mol·L-1(已知:Ksp(AgBr)= 7.7×10-13,Ag++ SCN-=AgSCN(白色)↓ ,Ksp(AgSCN)= 1×10-12)。
Ⅱ、某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。实验装置如图所示。
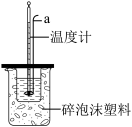
(6)仪器a的名称是_______ 。
(7)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则计算得中和热ΔH=______ (取小数点后一位)。
(8)上述实验结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是_____ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则滴定结束时的读数为

| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1硫酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据计算可得该NaOH溶液的物质的量浓度为
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸
B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.锥形瓶用水洗涤后,用待测液润洗
(5)酸碱中和滴定原理也可用于其它类型的滴定。如:一种测定水样中Br-的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1 mol/L AgNO3溶液(过量),充分摇匀。
③用c2mol/L KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL。
计算该水样中Br-的物质的量浓度为
Ⅱ、某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。实验装置如图所示。

(6)仪器a的名称是
(7)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则计算得中和热ΔH=
(8)上述实验结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


