解答题-工业流程题 适中0.65 引用1 组卷81
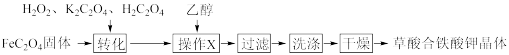
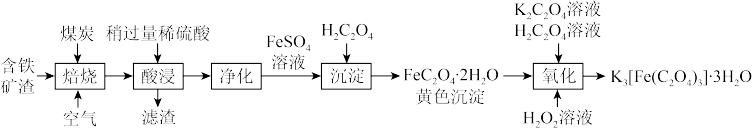
草酸合铁(III)酸钾晶体,即Ka[Fe(C2O4)b]·cH2O,是制备某些铁触媒的主要原料。该配合物易溶于水,难溶于乙醇,对光敏感,光照下即发生分解。可用如下流程来制备。根据题意完成下列各题:
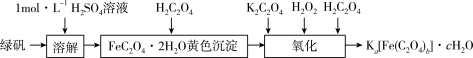
(1)1mol·L-1H2SO4溶液__________ (填“能”或“不能”)与绿矾反应。
(2)流程的“氧化”这一步,是依次加入一定量的饱和K2C2O4溶液、H2C2O4溶液、3%H2O2溶液,不断搅拌溶液并维持在40℃左右。充分反应后,沉淀溶解,溶液的pH保持在4~5,此时溶液呈翠绿色,趁热将溶液过滤到烧杯中,____________ (补充必要的步骤),得草酸合铁(III)酸钾晶体。
(3)写出在“氧化”这一步中,使沉淀溶解生成翠绿色溶液的离子方程式:________ ,该反应中的还原剂是(填化学式)_________ 。
(4)草酸合铁(III)酸钾晶体光照下立即发生分解生成两种草酸盐、CO2等,写出该反应的化学方程式:___________ 。
(5)某学生想测定草酸合铁(III)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}的组成,查阅资料,发现该晶体加热到110°C时仅完全失去结晶水。在实验室通过下列方法完成了该过程。具体如下:
步骤1:准确称取两份质量均为0.4910g的草酸合铁(III)酸钾样品。
步骤2:一份在N2氛围下保持110°C加热至恒重,称得残留固体质量为0.4370g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱{发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-},用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500mol·L-1的AgNO3溶液滴定至终点,消耗AgNO3溶液20.00mL。
①若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量_______ (填“偏大”“偏小”或“不变”)。
②草酸合铁(III)酸钾样品的化学式为__________ 。

(1)1mol·L-1H2SO4溶液
(2)流程的“氧化”这一步,是依次加入一定量的饱和K2C2O4溶液、H2C2O4溶液、3%H2O2溶液,不断搅拌溶液并维持在40℃左右。充分反应后,沉淀溶解,溶液的pH保持在4~5,此时溶液呈翠绿色,趁热将溶液过滤到烧杯中,
(3)写出在“氧化”这一步中,使沉淀溶解生成翠绿色溶液的离子方程式:
(4)草酸合铁(III)酸钾晶体光照下立即发生分解生成两种草酸盐、CO2等,写出该反应的化学方程式:
(5)某学生想测定草酸合铁(III)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}的组成,查阅资料,发现该晶体加热到110°C时仅完全失去结晶水。在实验室通过下列方法完成了该过程。具体如下:
步骤1:准确称取两份质量均为0.4910g的草酸合铁(III)酸钾样品。
步骤2:一份在N2氛围下保持110°C加热至恒重,称得残留固体质量为0.4370g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱{发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-},用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500mol·L-1的AgNO3溶液滴定至终点,消耗AgNO3溶液20.00mL。
①若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量
②草酸合铁(III)酸钾样品的化学式为
20-21高三上·吉林·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网